12.5. Quy tắc octet không được sử dụng khi xem xét sự hình thành của hai loại liên kết hoặc tương
tác nào sau đây?
(1) Liên kết cộng hóa trị. (2) Liên kết ion.
(3) Liên kết hydrogen. (4) Tương tác van der Waals.
A. (1) và (2). B. (2) và (3). C. (1) và (3). D. (3) và (4).
12.6. Nếu giữa phân tử chất tan và dung môi có thể tạo thành liên kết hydrogen hoặc có tương tác
van der Waals càng mạnh với nhau thì càng tan tốt vào nhau.
Lí do nào sau đây là phù hợp để giải thích dầu hỏa (thành phần chính là hydrocarbon) không tan
trong nước?
A. Cả nước và dầu đều là các phân tử có cực.
B. Nước là phân tử phân cực và dầu là không/ ít phân cực.
C. Nước là phân tử không phân cực và dầu là phân cực.
D. Cả nước và dầu đều không phân cực.
12.7. Ethanol tan vô hạn trong nước do
A. Cả nước và ethanol đều là phân tử phân cực.
B. Nước và ethanol có thẻ tạo liên kết hydrogen với nhau.
C. ethanol có thể tạo liên kết hydrogen với các phân tử ethanol khác.
D. ethanol và nước có tương tác van der Waals mạnh.

Những câu hỏi liên quan
Trình bày sự giống và khác nhau của 3 loại liên kết: Liên kết ion, liên kết cộng hóa trị không cực và liên kết cộng hóa trị có cực.
Tham khảo:
| So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
| Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm (2e hoặc 8e) | ||
| Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn |
| Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh và yếu khác |
Đúng 1
Bình luận (0)
Trình bày sự giống nhau và khác nhau của 3 loại liên kết : Liên kết ion, liên kết cộng hóa trị không có cực và liên kết cộng hóa trị có cực.
| So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
| Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm (2e hoặc 8e) | ||
| Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn |
| Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh và yếu khác |
| Nhận xét | Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion | ||
Đúng 1
Bình luận (0)
Trình bày sự giống và khác nhau của 3 loại liên kết: Liên kết ion, liên kết cộng hóa trị không cực và liên kết cộng hóa trị có cực.
So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm ( 2e hoặc 8e ). | ||
Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn. |
Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh yếu khác nhau |
Nhận xét | Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion. | ||
Đúng 1
Bình luận (0)
Liên kết hoá học được hình thành do sự di chuyển những eleron lớp ngoài cùng của nguyên tử để tạo thành cặp electron liên kết là kiểu
A. liên kết ion B. liên kết cộng hoá trị.
C. liên kết kim loại. D. liên kết hiđro.
Vận dụng quy tắc octet để giải thích sự hình thành liên kết hóa học trong một số phân tử của các nguyên tử nguyên tố nhóm A.
Quy tắc octet: Khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Ví dụ:
- Phân tử O2
Khi hình thành liên kết hoá học trong phân tử O2, nguyên tử oxygen có 6 electron hoá trị, mỗi nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hoà theo quy tắc octet nên mỗi nguyên tử oxygen góp chung 2 electron.
Phân tử O2 được biểu diễn như sau:

Đúng 0
Bình luận (0)
Hợp chất nào sau đây trong phân tử có cả 3 loại liên kết (cộng hóa trị, ion và liên kết cho nhận) ? A. KNO3 B. K2CO3 C. CH3COONa D. HNO3
Đọc tiếp
Hợp chất nào sau đây trong phân tử có cả 3 loại liên kết (cộng hóa trị, ion và liên kết cho nhận) ?
A. KNO3
B. K2CO3
C. CH3COONa
D. HNO3
Ở hình bên, ta thấy 1 nguyên tử carbon liên kết với 4 nguyên tử hydrogen hoặc chỉ liên kết với 2 nguyên tử oxygen; 1 nguyên tử oxygen liên kết được với 2 nguyên tử hydrogen;… Các nguyên tử liên kết với nhau theo nguyên tắc nào? Bằng cách nào để lập được công thức hóa học của các chất?
Đọc tiếp
Ở hình bên, ta thấy 1 nguyên tử carbon liên kết với 4 nguyên tử hydrogen hoặc chỉ liên kết với 2 nguyên tử oxygen; 1 nguyên tử oxygen liên kết được với 2 nguyên tử hydrogen;… Các nguyên tử liên kết với nhau theo nguyên tắc nào? Bằng cách nào để lập được công thức hóa học của các chất?
Các nguyên tử liên kết với nhau theo nguyên tắc hóa trị: trong phân tử hợp chất 2 nguyên tố, tích hóa trị và số nguyên tử của nguyên tố này bằng tích hóa trị và số nguyên tử của nguyên tố kia
- Để lập được công thức hóa học của các chất:
+ Xác định công thức hóa học dựa vào phần trăm nguyên tố và khối lượng phân tử
+ Xác định công thức hóa học dựa vào quy tắc hóa trị
Đúng 0
Bình luận (0)
Thế nào là liên kết ion, liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực, liên kết cộng hóa trị có cực. Cho thí dụ minh họa.
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu.
Thí dụ : K+ + Cl- → KCl.
Liên kết cộng hóa trị không cực là liên kết được tạo nên giữa hai nguyên tử bằng những cặp electron chung.
Thí dụ:
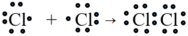
Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực
Thí dụ:
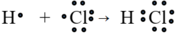
hay H – Cl
Đúng 0
Bình luận (0)
Câu 30: Cho nguyên tử: 17Y liên kết hóa học giữa hai nguyên tử Y và Y thuộc loạiA. liên kết ion. B. liên kết cộng hóa trị phân cực.C. liên kết cộng hóa trị không phân cực. D. liên kết cho – nhận.Câu 31: Trong ion Mg2+, số oxi hóa của Mg làA. +2. B. +3. C. +5. D. +4.Câu 32: Trong ion PO43-, số oxi hóa của P làA. +3. B. +2. C. +5. D. +4.Câu 33: Số oxi hoá của Nitơ trong: NH4+, NO2, HNO3 lần lượt là:A. +1...
Đọc tiếp
Câu 30: Cho nguyên tử: 17Y liên kết hóa học giữa hai nguyên tử Y và Y thuộc loại
A. liên kết ion. B. liên kết cộng hóa trị phân cực.
C. liên kết cộng hóa trị không phân cực. D. liên kết cho – nhận.
Câu 31: Trong ion Mg2+, số oxi hóa của Mg là
A. +2. B. +3. C. +5. D. +4.
Câu 32: Trong ion PO43-, số oxi hóa của P là
A. +3. B. +2. C. +5. D. +4.
Câu 33: Số oxi hoá của Nitơ trong: NH4+, NO2, HNO3 lần lượt là:
A. +1, +4, +5. B. +3, +4, +5. C. -3, +4, +5. D. +4, -4, +5.
Câu 34: Số oxi hoá của S trong S2-; H2SO4 lần lượt là:
A. -2;+6. B. 2-; +6. C. -2; +6. D. 0;+6.
Câu 35: Số oxi hoá của các nguyên tố Cl, S, C trong các hợp chất sau: HClO3; SO2; CO32- lần lượt là
A. +5; +4; +4. B. +1; +3; +4. C. +1; +5; +4. D. +3; +4; +5.
Câu 36: Số oxi hoá của Clo trong các hợp chất: NaClO3; Cl2O; NaCl lần lựơt là:
A. +5; +2; +1. B. +5; +1; +1. C. +6; +2; -1. D. +5; +1; -1.
Câu 37: Số oxi hoá của nitơ trong NO2-; NO; HNO3 lần lượt là:
A. +3; +2; +6. B. +3; -1; +5. C. +3; +2; +5. D. +4; -2; -5.
Câu 38: Số oxi hoá của mangan trong các chất: MnO2, K2MnO4, KMnO4, MnCl2, Mn là
A. + 4, + 6, + 7, + 2, 0. B. + 4, +2, 0, + 6, + 7.
C. + 4, + 2, 0, + 7, + 6. D. + 4, 0, + 2, + 7, + 6.
Câu 39: Số oxi hoá của lưu huỳnh trong các chất: H2S, S, SO3, SO2, Na2SO4, FeS, FeS2 lần lượt là
A. – 2, 0, + 6, + 4, + 6, – 2, – 1. B. – 2, 0, + 6, + 6, + 4, – 2, – 1.
C. – 2, 0, + 4, + 6, + 6, – 2, – 1 D. – 2, 0, + 6, + 4, + 4, – 2, – 1.
Câu 40: Cho một số hợp chất: H2S, H2SO3, H2SO4, NaHS, Na2SO3, SO3, K2S, SO2. Dãy các chất trong đó S có cùng số oxi hóa là
A. H2S, H2SO3, H2SO4.
B. H2SO3, H2SO4, Na2SO3, SO3.
C. H2SO3, H2SO4, Na2SO3, SO2.
D. H2S, NaHS, K2S.
30C
31: A
32: C
33: C
34: A
35: A
36: D
37: C
38: A
39: A
40: D
Đúng 0
Bình luận (0)
Câu 1: Hợp chất nào sau đây có liên kết ion? A. KCl. B. HCl. C. NH3. D. H2O. Câu 2: Hợp chất nào sau đây có liên kết ion? A. HCl. B. H2. C. MgO. D. H2O. Câu 3: Liên kết hóa học được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu gọi là A. liên kết cộng hóa trị có cực.B. liên kết kim loại. C. liên kết cộng hóa trị không cực. D. liên kết ion. Câu 4: Liên kết ion tạo thành giữa hai nguyên tử A. kim loại điển hình. B. phi kim điển hình. C. kim loại và p...
Đọc tiếp
Câu 1: Hợp chất nào sau đây có liên kết ion?
A. KCl.
B. HCl.
C. NH3.
D. H2O.
Câu 2: Hợp chất nào sau đây có liên kết ion?
A. HCl.
B. H2.
C. MgO.
D. H2O.
Câu 3: Liên kết hóa học được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu gọi là
A. liên kết cộng hóa trị có cực.
B. liên kết kim loại.
C. liên kết cộng hóa trị không cực.
D. liên kết ion.
Câu 4: Liên kết ion tạo thành giữa hai nguyên tử
A. kim loại điển hình.
B. phi kim điển hình.
C. kim loại và phi kim.
D. kim loại điển hình và phi kim điển hình.
Câu 5: Chỉ ra nội dung sai khi nói về ion:
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion được hình thành khi nguyên tử nhường hay nhận electron.
Câu 6: Nguyên tử của nguyên tố clo có 7 electron ở lớp ngoài cùng, khi tham gia liên kết với các nguyên tố khác, oxi có xu hướng:
A. nhận thêm 1 electron.
B. nhường đi 2 electron.
C. nhận thêm 2 electron.
D. nhường đi 6 electron.
Câu 7: Phân tử KCl được hình thành do
A. sự kết hợp giữa hai nguyên tử K và Cl.
B. sự kết hợp giữa hai ion K+ và Cl2-.
C. sự kết hợp giữa hai ion K- và Cl+.
D. sự kết hợp giữa hai ion K+ và Cl-.
Câu 8: Nhóm hợp chất nào sau đây đều là hợp chất ion?
A. H2S, Na2O.
B. CH4, CO2.
C. CaO, NaCl.
D. SO2, KCl.
Câu 9: Hợp chất nào sau đây có chứa liên kết ion trong phân tử:
A. Na2O; KCl; HCl.
B. K2O; BaCl2; CaF.
C. Na2O; H2S; NaCl.
D. CO2; K2O; CaO.
Câu 10: Có 2 nguyên tố X (Z = 19); Y (X = 17) hợp chất tạo bởi X và Y có công thức và kiểu liên kết là:
A. XY, liên kết ion.
B. X2Y, liên kết ion.
C. XY, liên kết cộng hóa trị có cực.
D. XY2, liên kết cộng hóa trị có cực.
....
Câu 11: Hợp chất nào sau đây có liên kết cộng hóa trị?
A. HCl.
B. MgO.
C. NaCl.
D. K2O.
Câu 12: Chất nào sau đây có liên cộng hóa trị không phân cực?
A. HCl.
B. NH3.
C. Cl2.
D. H2O.
Câu 13: Chất nào sau đây có liên cộng hóa trị phân cực?
A. O2.
B. NH3.
C. Cl2.
D. H2.
Câu 14: Trong phân tử sẽ có liên kết cộng hoá trị không phân cực nếu cặp electron chung
A. ở giữa hai nguyên tử.
B. lệch về một phía một nguyên tử.
C. chuyển hẳn về một nguyên tử.
D. nhường hẳn về một nguyên tử.
Câu 15: Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
A. ở giữa hai nguyên tử.
B. lệch về một phía một nguyên tử.
C. chuyển hẳn về một nguyên tử.
D. nhường hẳn về một nguyên tử.
Câu 16: Liên kết cộng hóa trị không phân cực thường là liên kết giữa:
A. Hai kim loại giống nhau.
B. Hai phi kim giống nhau.
C. Một kim loại mạnh và một phi kim mạnh.
D. Một kim loại yếu và một phi kim yếu.
Câu 17: Tùy thuộc vào số cặp electron dùng chung tham gia tạo thành liên kết cộng hóa trị giữa 2 nguyên tử mà liên kết được gọi là:
A. liên kết phân cực, liên kết lưỡng cực, liên kết ba cực.
B. liên kết đơn giản, liên kết phức tạp.
C. liên kết đơn, liên kết đôi, liên kết ba.
D. liên kết xích ma, liên kết pi, liên kết đelta.
Câu 18: Liên kết cộng hóa trị là liên kết giữa 2 nguyên tử
A. phi kim, được tạo thành do sự góp chung electron.
B. khác nhau, được tạo thành do sự góp chung electron.
C. được tạo thành do sự góp chung một hay nhiều electron.
D. được tạo thành từ sự cho nhận electron giữa chúng.
....
Câu 19: Điện tích quy ước của các nguyên tử trong phân tử, nếu coi phân tử có liên kết ion được gọi là
A. điện tích nguyên tử.
B. số oxi hóa.
C. điện tích ion.
D. cation hay anion.
Câu 20: Số oxi hóa của S trong phân tử H2SO4 là
A. +4.
B. +6.
C. -4.
D. -6.
Câu 21: Số oxi hóa của Mn trong phân tử KMnO4 là
A. +6.
B. +7.
C. -6.
D. -7.
Câu 11: Số oxi hóa của Cl trong phân tử NaClO3 là
A. +5.
B. +7.
C. -5.
D. -7.
Câu 22: Số oxi hóa của Cr trong phân tử K2Cr2O7 là
A. -6.
B. -3.
C. +3.
D. +6.
Câu 23: Số oxi hóa của N trong ion là
A. +3.
B. -5.
C. +5.
D. -3.
Câu 24: Số oxi hóa của C trong ion là
A. -6.
B. -4.
C. +6.
D. +4.
Câu 25: Số oxi hóa của Cl trong các hợp chất KCl, KClO, KClO2; KClO3, KClO4 lần lượt là
A. -1; +3; +1; +5; +7.
B. -1; +1; +3; +5; +7.
C. -1; +5; +3; +1; +7.
D. -1; +1; +3; +7; +5.
Câu 26: Cho 0,83 gam hỗn hợp gồm Al và Fe tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 0,56 lít khí H2 (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp lần lượt là:
A. 32,53% và 67,47%.
B. 67,5% và 32,5%.
C. 55% và 45%.
D. 45% và 55%.
.....
Câu 27: Hãy cho biết là quá trình nào sau đây?
A. Oxi hóa.
B. Khử.
C. Nhận proton.
D. Tự oxi hóa – khử.
Câu 28: Hãy cho biết là quá trình nào sau đây?
A. Oxi hóa.
B. Khử.
C. Nhận proton.
D. Tự oxi hóa – khử.
Câu 29: Chất khử trong phản ứng là
A. Mg.
B. HCl.
C. MgCl2.
D. H2.
Câu 30: Chất oxi hóa trong phản ứng là
A. Ag.
B. AgNO3.
C. Cu.
D. Cu(NO3)2.
Câu 31: Chất bị oxi hóa trong phản ứng là
A. Na.
B. H2O.
C. NaOH.
D. H2.
Câu 32: Chất bị khử trong phản ứng là
A. Cu.
B. H2SO4.
C. CuSO4.
D. SO2.
Câu 33: Vai trò của H2S trong phản ứng 2FeCl3 + H2S 2FeCl2 + S + 2HCl là
A. chất oxi hóa.
B. chất khử.
C. axit.
D. axit và chất khử.
Câu 34: Trong phản ứng nào dưới đây cacbon thể hiện đồng thời tính oxi hoá và tính khử?
A. B.
C. D.
Câu 35: Vài trò của HCl trong phản ứng MnO2 + 4HCl MnCl2 + Cl2 + 2H2O là
A. oxi hóa.
B. chất khử.
C. tạo môi trường.
D. chất khử và môi trường.
Câu 36: Cho phương trình hoá học: Hệ số nguyên và tối giản của chất oxi hoá là
A. 2.
B. 4.
C. 1.
D. 3.
Câu 37: Cho phương trình hoá học: Tỉ lệ a : b là
A. 1 : 3.
B. 1 : 2.
C. 2 : 3.
D. 2 : 9.
Câu 38: Cho phương trình phản ứng sau: Nếu hệ số của HNO3 là 8 thì tổng hệ số của Zn và NO là:
A. 4.
B. 3.
C. 6.
D. 5.
Câu 39: Hòa tan hoàn toàn 7,8 gam hỗn hợp gồm Al và Mg trong dung dịch HCl (dư), thu được 8,96 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 22,4.
B. 28,4.
C. 36,2.
D. 22,0.
Câu 40: Hoà tan 7,8 gam hỗn hợp bột Al và Mg trong dung dịch HCl dư. Sau phản ứng khối lượng dung dịch axit tăng thêm 7,0 gam. Khối lượng nhôm và magie trong hỗn hợp đầu là
A. 2,7 gam và 1,2 gam.
B. 5,4 gam và 2,4 gam.
C. 5,8 gam và 3,6 gam.
D. 1,2 gam và 2,4 gam.
















