Tính thể tích nước và thể tích dung dịch NaOH 2M cần để pha chế 100ml dung dịch NaOH 0,4M

Những câu hỏi liên quan
Câu 17. Thể tích dung dịch HCl 0,6M cần để trung hoà 150ml dung dịch NaOH 0,4M là
A. 20ml B. 100ml C. 50ml D. 80ml
\(NaOH+HCl \to NaCl+H_2O\\ n_{NaOH}=0,06(mol)\\ \to n_{HCl}=0,06(mol)\\ V_{HCl}=\frac{0,06}{0,6}=0,1(l)=100(ml)\)
Đúng 0
Bình luận (0)
\(n_{OH^-}=0,4.0,15=0,06\left(mol\right)\)
\(n_{H^+}=0,6.V_{HCl}\)
Để trung hòa thì \(0,6.V_{HCl}=0,06\Rightarrow V_{HCl}=0,1\left(l\right)=100\left(ml\right)\)
Đúng 0
Bình luận (0)
để pha chế 400 ml dung dịch 2m thì thể tích dung dịch HCl 10m và thể tích nước cần dùng là
n HCl = 0,4.2 = 0,8(mol)
=> V dd HCl 10M = 0,8/10 = 0,08(lít) = 80(ml)
=> V nước cần dùng = 400 -80 = 320(ml)
Đúng 1
Bình luận (0)
Cần bao nhiêu gam NaOH và bao nhiêu lít dung dịch NaOH 0,4M để pha chế được 2 lít dung dịch NaOH 2M (D = 1,05 g/ml). Biết D H2O = 1g/ml
tính thể tích dung dịch NaOH 1M cần dùng vừa đủ để trung hòa hết 100ml dung dịch hỗn hợp gồm HCl 1M và H2SO4 1M
\(\left\{{}\begin{matrix}n_{HCl}=0,1.1=0,1\left(mol\right)\\n_{H_2SO_4}=0,1.1=0,1\left(mol\right)\end{matrix}\right.\)
PTHH:
\(NaOH+HCl\rightarrow NaCl+H_2O\)
0,1<------0,1
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2<--------0,1
\(\Rightarrow V_{ddNaOH}=\dfrac{0,2+0,1}{1}=0,3\left(l\right)\)
Đúng 1
Bình luận (0)
Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
Tính thể tích nước cần dung để pha loãng.
Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: 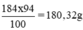
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: 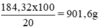
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
Đúng 1
Bình luận (0)
Để pha chế 250ml dung dịch NaOH 0,5M cần bao nhiêu ml dung dịch NaOH 2M và bao nhiêu ml nước?
Help me please!!!!
Theo đề bài ta có
Số mol của NaOH hòa tan trong 250 ml dd NaOH 0,5M là
nNaOH=CM.V=0,5.0,25=0,125 mol
⇒⇒ Thể tích dung dịch NaOH 2M trong đó có chứa 0,125 mol NaOH là
\(v=\frac{n}{CM}=\frac{0,125}{2}=0,0625l=6,25ml\)
Đúng 0
Bình luận (0)
Theo đề bài ta có:
Số mol của NaOH hòa tan trong 250 ml dd NaOH 0,5M là
nNaOH=CM.V=0,5.0,25=0,125 mol
⇒ Thể tích dung dịch NaOH 2M trong đó có chứa 0,125 mol NaOH là
V=\(\frac{n}{CM}\)=\(\frac{0,125}{2}\)= 0,0625l = 6,25ml
Đúng 0
Bình luận (1)
tính thể tích dung dịch NaOH 1M cần dùng vừa đủ để trung hòa hết 100ml dung dịch hỗn hợp gồm HCl 1M và H2SO4 1M 02Bài giải:
Đọc tiếp
tính thể tích dung dịch NaOH 1M cần dùng vừa đủ để trung hòa hết 100ml dung dịch hỗn hợp gồm HCl 1M và H2SO4 1M
02Bài giải:\(n_{HCl}=0,1.1=0,1\left(mol\right);n_{H_2SO_4}=0,1.1=0,1\left(mol\right)\)
PTHH:
`NaOH + HCl -> NaCl + H_2O`
`2NaOH + H_2SO_4 -> Na_2SO_4 + 2H_2O`
Theo PT: `n_{NaOH} = 2n_{H_2SO_4} + n_{HCl} = 0,3 (mol)`
`=> V_{ddNaOH} = (0,3)/(1) = 0,3(l)`
Đúng 2
Bình luận (0)
Câu 10: Tính thể tích nước cất và dung dịch H2SO4 2M cần để pha 80ml dung dịch H2SO4 1M.
Đọc tiếp
Câu 10: Tính thể tích nước cất và dung dịch H2SO4 2M cần để pha 80ml dung dịch H2SO4 1M.
Ta có: \(n_{H_2SO_4}=0,08.1=0,08\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4\left(2M\right)}=\dfrac{0,08}{2}=0,04\left(l\right)=40\left(ml\right)\)
⇒ VH2O = 80 - 40 = 40 (ml)
Đúng 2
Bình luận (0)
Để trung hoà 200 ml dung dịch NaOH 1,5M thì thể tích dung dịch HCl 0,4M cần dùng là bao nhiêu?
$200ml=0,2l$
$n_{NaOH}=0,2.1,5=0,3(mol)$
$H^++OH^-\to H_2O$
$\to n_{H^+}=n_{HCl}=n_{OH^-}=n_{NaOH}=0,3(mol)$
$\to V_{dd\,HCl}=\dfrac{0,3}{0,4}=0,75(l)=750(ml)$
Đúng 4
Bình luận (1)

























