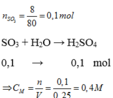Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng hết với nước thu được dung dịch axit sunfuric (H2SO4). a) Viết phương trình hóa học của phản ứng xảy ra. b) Cho quỳ tím vào sản phẩm của phản ứng trên thì có hiện tượng như thế nào. c) Tính khối lượng axit sunfuric thu được. d) Xác định nồng độ mol của 250ml dung dịch axit sunfuric thu được ở trên.

Những câu hỏi liên quan
cho 32 gam lưu huỳnh trioxit (SO3) tác dụng hết với nước thu được dung dịch axit sunfuric (H2SO4)
a, Viết PTHH của phản ứng xảy ra
b, tính khối lượng axit sunfuric thu được
a) \(n_{SO_3}=\dfrac{m}{M}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: `SO_3 + H_2O -> H_2SO_4`
b) Theo PTHH: `n_{H_2SO_4} = n_{SO_3} = 0,4 (mol)`
`=> m_{H_2SO_4} = 0,4.98 = 39,2 (g)`
Đúng 0
Bình luận (0)
1. Cho 8 gam lưu huỳnh trioxit tác dụng với nước, thu được 250 ml dung dịch axit sunfuric.a. Viết phương trình phản ứng hóa học xảy ra.b. Xác định nống độ mol của dung dịch axit thu được.2. Cho 1,6 gam đồng (II)oxit tác dụng với 100g dung dịch axit sunfuric có nồng độ 20%.a. Viết phương trình phản ứng hóa học xảy ra.b. Tính nồng độ phần trăm các chất trong dung dịch sau khi phản ứng kết thúc.
Đọc tiếp
1. Cho 8 gam lưu huỳnh trioxit tác dụng với nước, thu được 250 ml dung dịch axit sunfuric.
a. Viết phương trình phản ứng hóa học xảy ra.
b. Xác định nống độ mol của dung dịch axit thu được.
2. Cho 1,6 gam đồng (II)oxit tác dụng với 100g dung dịch axit sunfuric có nồng độ 20%.
a. Viết phương trình phản ứng hóa học xảy ra.
b. Tính nồng độ phần trăm các chất trong dung dịch sau khi phản ứng kết thúc.
Bài 1 :
\(n_{SO3}=\dfrac{8}{80}=0,1\left(mol\right)\)
a) Pt : \(SO_3+H_2O\rightarrow H_2SO_4|\)
1 1 1
0,1 0,1
b) \(n_{H2SO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
250ml = 0,25l
\(C_{M_{ddH2SO4}}=0,4\left(M\right)\)
Chúc bạn học tốt
Đúng 2
Bình luận (0)
Bài 2 :
\(n_{CuO}=\dfrac{1,6}{80}=0,02\left(mol\right)\)
\(m_{ct}=\dfrac{20.100}{100}=20\left(g\right)\)
\(n_{h2SO4}=\dfrac{20}{98}=0,2\left(mol\right)\)
a) Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
0,02 0,2 0,02
b) Lập tỉ số so sánh : \(\dfrac{0,02}{1}< \dfrac{0,2}{1}\)
⇒ CuO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
\(n_{CuSO4}=\dfrac{0,02.1}{1}=0,02\left(mol\right)\)
⇒ \(m_{CuSO4}=0,02.160=3,2\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,2-0,02=0,18\left(mol\right)\)
⇒ \(m_{h2SO4\left(dư\right)}=0,18.98=17,64\left(g\right)\)
\(m_{ddspu}=1,6+100=101,6\left(g\right)\)
\(C_{CuSO4}=\dfrac{3,2.100}{101,6}=3,15\)0/0
\(C_{H2SO4\left(dư\right)}=\dfrac{17,64.100}{101,6}=17,36\)0/0
Chúc bạn học tốt
Đúng 2
Bình luận (0)
Cho 8 gam lưu huỳnh trioxit ( SO 3 ) tác dụng với H 2 O , thu được 250 ml dung dịch axit sunfuric ( H 2 SO 4 ).
Viết phương trình hoá học.
Phương trình hoá học :
SO 3 + H 2 O → H 2 SO 4
Đúng 0
Bình luận (0)
cho 8 g lưu huỳnh trioxit tác dụng với nước ,thu được 250ml dung dịch axit sunfuric
a) viết phương trình hóa học
b)xác định nồng độ mol của dung dịch axit
c)nếu trung hòa hết lượng axit thu được ở trên bằng dung dịch KOH 5,6% có khối lượng riêng là 1,045 g/ml thì cần bao nhiêu ml dung dịch KOH ?
Ta có: \(n_{SO_3}=\dfrac{8}{80}=0,1\left(mol\right)\)
a. PTHH: SO3 + H2O ---> H2SO4 (1)
b. Theo PT(1): \(n_{H_2SO_4}=n_{SO_3}=0,1\left(mol\right)\)
Đổi 250ml = 0,25 lít
=> \(C_{M_{H_2SO_4}}=\dfrac{0,1}{0,25}=0,4\left(M\right)\)
c. PTHH: H2SO4 + 2KOH ---> K2SO4 + 2H2O
Theo PT(2): \(n_{KOH}=2.n_{H_2SO_4}=2.0,1=0,2\left(mol\right)\)
=> \(m_{KOH}=0,2.56=11,2\left(g\right)\)
Ta có: \(C_{\%_{KOH}}=\dfrac{11,2}{m_{dd_{KOH}}}.100\%=5,6\%\)
=> \(m_{dd_{KOH}}=200\left(g\right)\)
Ta có: \(d_{KOH}=\dfrac{200}{V_{dd_{KOH}}}=1,045\)(g/ml)
=> \(V_{dd_{KOH}}=191,4\left(ml\right)\)
Đúng 0
Bình luận (0)
Cho 10,8 gam nhôm tác dụng vừa đủ với dung dịch có chứa 58,8 gam axit sunfuric (H2SO4) thu được m gam muối nhôm sunfat (Al2(SO4)3) và 1,2 gam khí hiđro.
Viết phương trình hóa học cho phản ứng xảy ra.
Viết công thức về khối lượng của phản ứng hóa học xảy ra.
Tính m?
ta có nhôm (Al) tác dụng với axit sunfuric (H2SO4) thu được khi hidro( h2) và hợp chất nhôm sunfat Al2(SO4)3 nên có phương trình hóa học: Al + H2SO4 -> H2 + Al2(SO4)3
theo định luật bảo tồn khối lượng ta có :
m Al + m H2SO4 = m H2+ m Al2(SO4)3
Câu cuối tính m mình chưa biết tính cái chi nên không tính được.
chúc bạn học tốt nhé
Đúng 1
Bình luận (0)
Cho 8 gam lưu huỳnh trioxit (
S
O
3
) tác dụng với
H
2
O
, thu được 250 ml dung dịch axit sunfuric (
H
2
S
O
4
). Nồng độ mol của dung dịch axit thu được là A. 0,1M B. 0,4M C. 0,5M D. 0,6M
Đọc tiếp
Cho 8 gam lưu huỳnh trioxit ( S O 3 ) tác dụng với H 2 O , thu được 250 ml dung dịch axit sunfuric ( H 2 S O 4 ). Nồng độ mol của dung dịch axit thu được là
A. 0,1M
B. 0,4M
C. 0,5M
D. 0,6M
Cho 8 gam lưu huỳnh trioxit ( SO 3 ) tác dụng với H 2 O , thu được 250 ml dung dịch axit sunfuric ( H 2 SO 4 ).
Xác định nồng độ mol của dung dịch axit thu được.
Nồng độ mol của dung dịch H 2 SO 4 :
n H 2 SO 4 = n SO 3 = 8/80 = 0,1 mol
Theo phương trình hoá học :
C Mdd H 2 SO 4 = 1000x0,1/250 = 0,4M
Đúng 0
Bình luận (0)
Hấp thụ hoàn toàn m gam SO3 vào nước , thu được 200 g dung dịch H2SO4 19,6%
a,Viết phương trình hóa học của phản ứng . Tính m
b, Lấy 80 gam dung dịch H2SO4 19,6% ở trên cho tác dụng vừa đủ với MgO . Tính khối lượng MgO đã tham gia phản ứng và tính nồng độ phần trăm của dung dịch thu được sau phản ứng
\(n_{H_2SO_4}=\dfrac{200\cdot19.6\%}{98}=0.4\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(0.4......................0.4\)
\(m_{SO_3}=0.4\cdot80=32\left(g\right)\)
\(b.\)
\(n_{H_2SO_4}=\dfrac{80\cdot19.6\%}{98}=0.16\left(mol\right)\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(0.16..........0.16..............0.16\)
\(m_{MgO}=0.16\cdot40=6.4\left(g\right)\)
\(m_{\text{dung dịch sau phản ứng}}=6.4+80=86.4\left(g\right)\)
\(C\%MgSO_4=\dfrac{0.16\cdot120}{86.4}\cdot100\%=22.22\%\)
Đúng 2
Bình luận (0)
a)
$SO_3 + H_2O \to H_2SO_4$
n SO3 = n H2SO4 = 200.19,6%/98 = 0,4(mol)
=> m = 0,4.80 = 32(gam)
b)
$MgO + H_2SO_4 \to MgSO_4 + H_2O$
n MgSO4 = n MgO = n H2SO4 = 80.19,6%/98 = 0,16(mol)
=> m MgO = 0,16.40 = 6,4(gam)
Sau pư, m dd = 6,4 + 80 = 86,4(gam)
=> C% MgSO4 = 0,16.120/86,4 .100% = 22,22%
Đúng 1
Bình luận (0)
Câu 8: Cho các chất sau : CuSO4 ; SO3 ; Fe ; BaCl2 ; Cu ; Na2O. Viết phương trình phản ứng của chất:
a. Tác dụng được với H2O tạo ra dung dịch làm quỳ tím hóa đỏ.
b. Tác dụng được với dung dịch H2SO4 loãng sinh ra chất kết tủa trắng không tan trong nước và axit.
c. Tác dụng được với dung dịch NaOH sinh ra chất kết tủa màu xanh lơ.
d. Tác dụng với dung dịch HCL sinh ra chất khí nhẹ hơn không khí và cháy được trong không khí.
Đọc tiếp
Câu 8: Cho các chất sau : CuSO4 ; SO3 ; Fe ; BaCl2 ; Cu ; Na2O. Viết phương trình phản ứng của chất: a. Tác dụng được với H2O tạo ra dung dịch làm quỳ tím hóa đỏ. b. Tác dụng được với dung dịch H2SO4 loãng sinh ra chất kết tủa trắng không tan trong nước và axit. c. Tác dụng được với dung dịch NaOH sinh ra chất kết tủa màu xanh lơ. d. Tác dụng với dung dịch HCL sinh ra chất khí nhẹ hơn không khí và cháy được trong không khí.