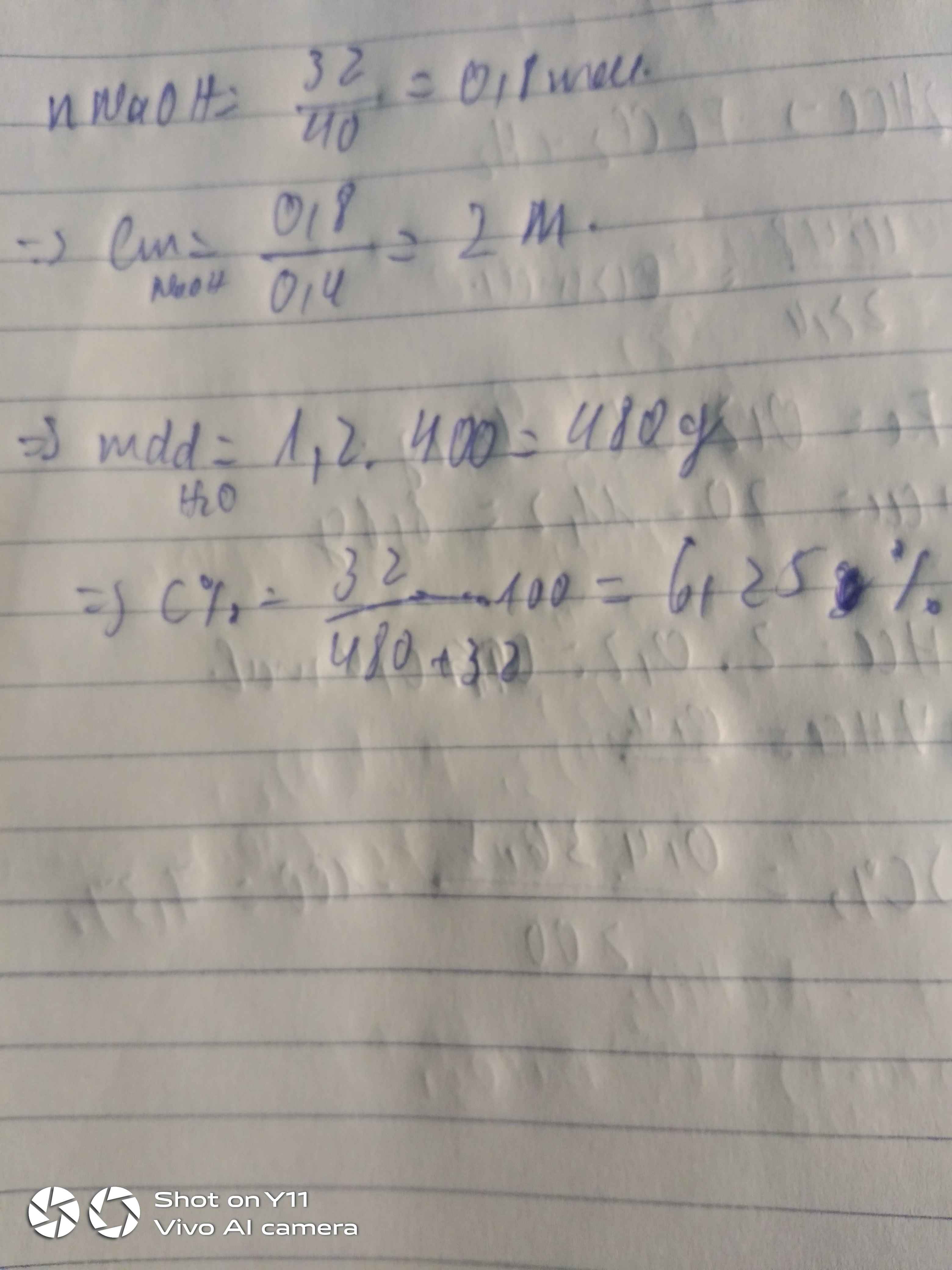Tính nồng độ mol của dd axit sunfuric nồng độ 19,6% có KL riêng d = 1,25g/ml

Những câu hỏi liên quan
1/Dung dịch axit CH3CooH 2.03M có D=1.017g/ml.Tính nồng đọ molan của dung dịch ?
2/dd axit sunfuric 27% có D=1.198. tính nồng độ mol/l và nồng độ molan của dd ?
a) dd axit HCl nồng độ 37% có D=1,19g/ml .tính nồng độ mol của dd
b) xác định nồng độ % của dd HCl 10,81 M có D =1,17g/mla) GS có x mol HCl
\(\Rightarrow m_{HCl}\)mHClHCl=36,5x
\(\Rightarrow m_{dd_{HCl}}\)=36,5x/37%=98,65x
\(\Rightarrow V_{dd}=\frac{m_{dd}}{D}\)=\(\frac{98,65x}{1,19}\)=82,9x (ml)
\(\Rightarrow CM_{dd_{HCl}}\)=x/0,0829x=12M
b) GS có x mol HCl
\(\Rightarrow m_{HCl}\)=36,5x
\(V_{dd_{HCl}}\)=x/10,81 lít
\(\Rightarrow m_{dd_{HCl}}\)=1/10,81.1000.1,17.x=108,233x
\(\Rightarrow\)C%=36,5/108,233.100%=33,72%
Đúng 0
Bình luận (0)
GS có x mol HClHCl
=>mHClHCl=36,5x
=>mdd HClHCl=36,5x/37%=98,65x
=>Vdd=mdd/D=98,65x/1,19=82,9x (ml)
=>CM dd HClHCl=x/0,0829x=12M
b) GS có x mol HClHCl
=>mHClHCl=36,5x
Vdd HClHCl=x/10,81 lít
=>mdd HClHCl=1/10,81.1000.1,17.x=108,233x
=>C%=36,5/108,233.100%=33,72%
Đúng 0
Bình luận (0)
giải cho em bài nàya)Tinh nồng độ % của dd H2sO4 khi cho 19,6g H2sO4vào 180,4g nươc b)Cho thêm nuoc vào 150g dd Axit HCl nồng độ 2,65% để tạo thành 2 L dd.Tinh nồng độ của dd thu được c)Phải lây bao nhiêu ml dd H2sO4 96%,KL riêng D=184g/ml để trong đo co 2,45g H2sO4
a)
m dd = m H2SO4 + m H2O = 19,6 + 180,4 = 200(gam)
=> C% H2SO4 = 19,6/200 .100% = 9,8%
b)
m HCl = 150.2,65% = 3,975 gam
n HCl = 3,975/36,5 = 0,11(mol)
=> CM HCl = 0,11/2 = 0,055M
c)
m dd H2SO4 = 2,45/96% = 2,552(gam)
=> V dd H2SO4 = m/D = 2,552/1,84 = 1,387(ml)
Đúng 1
Bình luận (0)
cho 8,4g bột sắt tác dụng với 200ml dd HCl 2M ( D= 1,25g/ml), thu được 200ml dung dịch A và V ml khí hidro (dktc)
a) tính V (ml)
b) tính nồng độ mol các chất tan trong dung dịch A
c) tính nồng độ % của chất tan trong dd A
a, \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{HCl}=0,2.2=0,4\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,4}{2}\), ta được HCl dư.
Theo PT: \(n_{H_2}=n_{Fe}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)=3360\left(ml\right)\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\\n_{HCl\left(pư\right)}=2n_{Fe}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=0,4-0,3=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{FeCl_2}}=\dfrac{0,15}{0,2}=0,75\left(M\right)\\C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\end{matrix}\right.\)
c, Ta có: \(m_{ddHCl}=1,25.200=250\left(g\right)\)
⇒ m dd sau pư = 8,4 + 250 - 0,15.2 = 258,1 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,15.127}{258,1}.100\%\approx7,38\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,1.36,5}{258.1}.100\%\approx1,41\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho một lượng bột sắt dư vào 50ml dd axit sunfuric. Phản ứng xong thu được 3,36 lít khí H2 (đkc).
a. Tính khối lượng sắt đã tham gia phản ứng.
b. Tính nồng độ mol của dd axit sunfuric đã dùng.
c. Tính nồng độ mol của dd thu được sau phản ứng (thể tích dd thay đổi không đáng kể)
a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
b)
$n_{H_2SO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{H_2SO_4}} = \dfrac{0,15}{0,05} = 3M$
c)
$n_{FeSO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{FeSO_4}} = \dfrac{0,15}{0,05} = 3M$
Đúng 1
Bình luận (1)
Hòa tan hoàn toàn 32 gam Fe2O3 vào 250 gam dung dịch axit clohiđric (HCl) vừa
đủ (khối lượng riêng là 1,25g/ml). Tính nồng độ mol dung dịch axit đã dùng
\(n_{Fe_2O_3}=0,2(mol)\\ Fe_2O_3+6HCl \to 2FeCl_3+3H_2O\\ n_{HCl}=1,2(mol)\\ V_{ddHCl}=\frac{250}{1,25}=200(ml)=0,2(l)\\ CM_{HCl}=\frac{1,2}{0,2}=6M$\)
Đúng 2
Bình luận (0)
Bài 24: Cho một dd chứa 44,8g dd Kali hidroxit 25% tác dụng với 100ml dd axit sunfuric 1,5M thu được dd A. a. Cho quỳ tím vào dd A thì thấy có hiện tượng gi? Giải thích? b. Tính nồng độ % của dd A biết khối lượng riêng của dd axit sunfuric là 1,1g/ml
a, \(n_{KOH}=\dfrac{44,8.25\%}{56}=0,2\left(mol\right);n_{H_2SO_4}=0,1.1,5=0,15\left(mol\right)\)
PTHH: 2KOH + H2SO4 → K2SO4 + H2O
Mol: 0,2 0,1 0,1
Ta có: \(\dfrac{0,2}{2}< \dfrac{0,15}{1}\) ⇒ KOH hết, H2SO4 dư
⇒ Khi cho quỳ tím vào sẽ lm quỳ tím chuyển đỏ (vì trong dd vẫn còn axit)
b) \(m_{ddH_2SO_4}=1,1.100=110\left(g\right)\)
⇒ mdd sau pứ = 44,8 + 110 = 154,8 (g)
\(C\%_{ddK_2SO_4}=\dfrac{0,1.174.100\%}{154,8}=11,24\%\)
Đúng 0
Bình luận (0)
Hòa tan lượng bột nhôm vào dd Axit Sunfuric 9,8%( D=1,25g/ml) sinh ra 13,44l khí(đktc). Hãy tính:
a/ Thể tích dd axit sunfuric đã dùng?
b/ Lấy 200g dd Axit Sunfuric trên tác dụng với 100g dd BaCl2 20,8%. Tính nồng độ % của các chất có trong dd sau phản ứng?
Cho 32g NaOH vào nước được 400ml dd có khối lượng riêng D=1,2g/ml . Tính nồng độ mol và nồng độ phần trăm của dung dịch