Hoà tan hoàn toàn Kim loại R trong 200ml dung dịch H2SO4 loãng không phải 2M xác định tên kim loại

Những câu hỏi liên quan
Hoà tan hoàn toàn 16 gam oxit kim loại M có hóa trị II cần dùng 200ml dung dịch H2SO4 loãng 1M. Xác định kim loại trong oxit trên?
A. Cu B. Mg C. Zn D. Ca
\(n_{H_2SO_4}=1\cdot0,2=0,2\left(mol\right)\\ PTHH:MO+H_2SO_4\rightarrow MSO_4+H_2O\\ \Rightarrow n_{MO}=n_{H_2SO_4}=0,2\left(mol\right)\\ \Rightarrow M_{MO}=\dfrac{16}{0,2}=80\left(g/mol\right)\\ \Rightarrow PTK_M=80-16=64\left(đvC\right)\)
Do đó M là Cu
Vậy chọn A
Đúng 3
Bình luận (0)
Hoà tan hoàn toàn 10.8g kim loại R cần 600g dung dịch H2SO4 9,8%. Xác định tên và kí hiệu hoá học của kim loại
n H2SO4 = 600.9,8%/98 = 0,6(mol)
Gọi n là hóa trị kim loại R
2R + nH2SO4 $\to$ R2(SO4)n + n H2
Theo PTHH :
\(n_R = \dfrac{2}{n}n_{H_2SO_4} = \dfrac{1,2}{n}(mol)\\ \Rightarrow \dfrac{1,2}{n}.R = 10,8\\ \Rightarrow R = 9n\)
Với n = 3 thì R = 27(Al)
Vậy R là kim loại nhôm
Đúng 1
Bình luận (0)
Cho 16,8 gam một kim loại R hóa trị 2 tan hoàn toàn trong dung dịch H2SO4 loãng thu được 6,72 lít khí (điều kiện tiêu chuẩn).Xác định tên kim loại ( R) và khối lượng muối thu được.
$R + H_2SO_4 \to RSO_4 + H_2$
$n_R = n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)$
$M_R = \dfrac{16,8}{0,3} =56(Fe)$
Vậy R là Sắt
$n_{FeSO_4} = n_{H_2} = 0,3(mol)$
$m_{FeSO_4} = 0,3.152 =45,6(gam)$
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 0,8 g một kim loại hoá trị II hoà tan hoàn toàn trong 100 ml H 2 S O 4 0,5 M. Lượng axit còn dư phản ứng vừa đủ với 33,4 ml dung dịch NaOH 1,00 M. Xác định tên kim loại.
Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
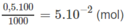
Số mol NaOH trong 33,4 ml nồng độ 1M :
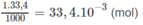
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 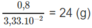
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.
Đúng 0
Bình luận (0)
hòa tan hoàn toàn 4.05g một kim loại nhóm iiiA bằng dung dịch h2so4 loãng dư sau phản ứng thu được 5.041 khí h2 đktc xác định tên của kim loại đó
Có lẽ đề phải là 5,04 lít khí bạn nhỉ?
Gọi kim loại cần tìm là A.
Có: \(n_{H_2}=0,225\left(mol\right)\)
PT: \(2A+6HCl\rightarrow2ACl_3+3H_2\)
___0,15__________________0,225 (mol)
\(\Rightarrow M_A=\dfrac{4,05}{0,15}=27\left(g/mol\right)\)
Vậy: A là nhôm (Al).
Bạn tham khảo nhé!
Đúng 0
Bình luận (2)
Hoà tan hoàn toàn một lượng kim loại R hóa trị n bằng dung dịch H2SO4 loãng rồi cô cạn dung dịch sau phản ứng thu được một lượng muối khan có khối lượng gấp 5 lần khối lượng kim loại R ban đầu đem hoà tan. Kim loại R đó là A. Al. B. Ba. C. Zn D. Mg.
Đọc tiếp
Hoà tan hoàn toàn một lượng kim loại R hóa trị n bằng dung dịch H2SO4 loãng rồi cô cạn dung dịch sau phản ứng thu được một lượng muối khan có khối lượng gấp 5 lần khối lượng kim loại R ban đầu đem hoà tan. Kim loại R đó là
A. Al.
B. Ba.
C. Zn
D. Mg.
Đáp án D
Khi hòa tan 1 mol kim loại R thì thu được 0,5 mol R2(SO4)n (khi n = 2 thì thu được 1 mol RSO4, có thể coi là 0,5 mol R2(S04)2)
0,5.(2R + 96n) = 5R Û R = 12n Þ n = 12, R = 24 là Mg.
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn một lượng kim loại R hóa trị n bằng dung dịch H2SO4 loãng rồi cô cạn dung dịch sau phản ứng thu được một lượng muối khan có khối lượng gấp 5 lần khối lượng kim loại R ban đầu đem hoà tan. Kim loại R đó là A. Al. B. Ba. C. Zn D. Mg.
Đọc tiếp
Hoà tan hoàn toàn một lượng kim loại R hóa trị n bằng dung dịch H2SO4 loãng rồi cô cạn dung dịch sau phản ứng thu được một lượng muối khan có khối lượng gấp 5 lần khối lượng kim loại R ban đầu đem hoà tan. Kim loại R đó là
A. Al.
B. Ba.
C. Zn
D. Mg.
Đáp án D
Khi hòa tan 1 mol kim loại R thì thu được 0,5 mol R2(SO4)n (khi n = 2 thì thu được 1 mol RSO4, có thể coi là 0,5 mol R2(S04)2)
0,5.(2R + 96n) = 5R Û R = 12n Þ n = 12, R = 24 là Mg.
Đúng 0
Bình luận (0)
Cho 9,6 gam hỗn hợp X gồm canxi và kim loai R (hóa trị II) tan hoàn toàn trong dung dịch H2SO4 loãng thu được 6,72 lit khí ( đktc). Xác định kim loại R
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Ca + H2SO4 → CaSO4 + H2
PTHH: R + H2SO4 → RSO4 + H2
\(\Rightarrow M_X=\dfrac{9,6}{0,3}=32\left(g/mol\right)\)
Mà \(M_X=\dfrac{M_{Ca}+M_R}{2}=\dfrac{40+M_R}{2}\)
\(\Rightarrow\dfrac{40+M_R}{2}=32\Leftrightarrow40+M_R=64\Leftrightarrow M_R=24\)
Vậy R là kim loại magie (Mg)
Đúng 0
Bình luận (0)
Cho 1,44g một kim loại R có hoá trị II phản ứng hoàn toàn trong 250ml dung dịch H2SO4 0,3M. Dung dịch thu được còn chứa axit dư và phải trung hoà axit dư bằng 60ml dung dịch NaOH 0,5M. Hãy xác định kim loại R
\(n_{NaOH}=0.06\cdot0.5=0.03\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\dfrac{0.03}{2}=0.015\left(mol\right)\)
\(n_{H_2SO_4\left(pư\right)}=0.25\cdot0.3-0.015=0.06\left(mol\right)\)
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(0.06....0.06\)
\(M_R=\dfrac{1.44}{0.06}=24\left(\dfrac{g}{mol}\right)\)
\(R:Mg\)
Đúng 3
Bình luận (0)
n NaOH = 0,06.0,5 = 0,03(mol)
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
n H2SO4 dư = 1/2 n NaOH = 0,015(mol)
n H2SO4 pư = 0,25.0,3 - 0,015 = 0,06(mol)
$R + H_2SO_4 \to RSO_4 + H_2$
n R = n H2SO4 pư = 0,06(mol)
M R = 1,44/0,06 = 24(Mg)
Vậy R là Magie
Đúng 3
Bình luận (0)




















