Bài 5. Tính tỉ lệ thể tích dung dịch HCl 18,25% (D = 1,2 g/ml) và thể tích dung dịch HCl 13% (D = 1,123 g/ml) để pha thành dung dịch HCl 4,5 M?

Những câu hỏi liên quan
Tính tỉ lệ thể tích dung dịch HCl 18,25% (D = 1,2 g/ml) và thể tích dung dịch HCl 13% (D = 1,123 g/ml) để pha thành dung dịch HCl 4,5 M?
Tóm tắt:
C%1 = 18,25%
D1= 1,2
C%2= 13%
D2= 1,123
CM3= 4,5M
Từ C%1 và D1 ta tính ra CM1
Từ C%2 và D1 tính ra CM2
Từ CM1 và CM2 ta tính đ.c CM(mới)
Giải
CM của dd (1) HCL là 18,25 :
CM(1) = C%.10.D/M = 18,25.10.12/36,5= 6 (M)
CM(2) = C%.10.D/M = 13. 10.1,123/36,5=4 (M)
Gọi V1 và V2 lần lượt là thể tích của dd(1) và dd(2)
Số mol của dd (1) HCL là:
n(1)= CM(1). V(1) = 6.V1
Số mol của dd(2) HCL là :
n(2) = CM(2).V(2) = 4V2
=> CM = n/V
=> 4,5=n1+n2/V1+V2 = 6V1+4V2/V1+V2
=> 4,5.(V1+V2) = 6V1+4V2
=> 4,5V1+4,5V2 = 6V1+4V2
=> -1,5V1 = 0,5V2
Tỉ lệ pha chế thành dd HCL là:
V1/V2 = 0,5/1,5 = 1/3
Đúng 0
Bình luận (0)
1. Thể tích dung dịch NaOH 0,1M tối thiểu cần cho vào dung dịch hỗn hợp chứa 0,01 mol HCl và 0,02 mol AlCl3 để lượng kết tủa thu được là cực đại bằng? 2. *Cho 500 ml dung dịch Ba(OH)2 0,1M vào V ml dung dịch Al2(SO4)3 0,1M; sau khi các phản ứng kết thúc thu được 12,045 gam kết tủa Giá trị của V là? 3. Hoà tan hoàn toàn 47,4 gam phèn chua KAl(SO4)2.12H2O (K2SO4.Al2(SO4)3.24H2O) vào nước, thu được dung dịch X. Cho toàn bộ X tác dụng với 200 ml...
Đọc tiếp
1. Thể tích dung dịch NaOH 0,1M tối thiểu cần cho vào dung dịch hỗn hợp chứa 0,01 mol HCl và 0,02 mol AlCl3 để lượng kết tủa thu được là cực đại bằng?
2. *Cho 500 ml dung dịch Ba(OH)2 0,1M vào V ml dung dịch Al2(SO4)3 0,1M; sau khi các phản ứng kết thúc thu được 12,045 gam kết tủa Giá trị của V là?
3. Hoà tan hoàn toàn 47,4 gam phèn chua KAl(SO4)2.12H2O (K2SO4.Al2(SO4)3.24H2O) vào nước, thu được dung dịch X. Cho toàn bộ X tác dụng với 200 ml dung dịch Ba(OH)2 1M, sau phản ứng thu được m gam kết tủA. Giá trị của m là?
giải 3 bài trên theo pthh, ko dùng pt ion ạ
B1:
Cho dd NaOH vào hỗn hợp thì dd NaOH sẽ phản ứng với HCl trước sau đó mới phản ứng với muối AlCl3
Để kết tủa là cực đại <=> Không có quá trình hoà tan Al(OH)3
\(NaOH+HCl\rightarrow NaCl+H_2O\\ AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\\ n_{NaOH}=n_{HCl}+3.n_{AlCl_3}=0,01+0,02.3=0,07\left(mol\right)\\ \Rightarrow V_{ddNaOH}=\dfrac{n_{NaOH}}{C_{MddNaOH}}=\dfrac{0,07}{0,1}=0,7\left(lít\right)\)
Đúng 3
Bình luận (0)
2)
\(n_{Al_2\left(SO_4\right)_3}=0,0001.V\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,5.0,1=0,05\left(mol\right)\)
PTHH: \(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\rightarrow3BaSO_4+2Al\left(OH\right)_3\)
0,0003.V<--0,0001.V------>0,0003.V-->0,0002.V
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\rightarrow Ba\left(AlO_2\right)_2+4H_2O\)
(0,1-0,0006.V)<-(0,05-0,0003.V)
=> 233.0,0003.V + 78.(0,0008.V-0,1) = 12,045
=> V = 150 (ml)
3) \(n_{K_2SO_4.Al_2\left(SO_4\right)_3.24H_2O}=\dfrac{47,4}{948}=0,05\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{K_2SO_4}=0,05\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(n_{Ba\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
PTHH: \(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\rightarrow3BaSO_4+2Al\left(OH\right)_3\)
0,15<-------0,05----------->0,15----->0,1
\(Ba\left(OH\right)_2+K_2SO_4\rightarrow BaSO_4+2KOH\)
0,05---------------------->0,05--->0,1
\(KOH+Al\left(OH\right)_3\rightarrow KAlO_2+2H_2O\)
0,1--->0,1
=> mkt = mBaSO4 = 0,2.233 = 46,6(g)
Đúng 2
Bình luận (0)
\(n_{Ba\left(OH\right)_2}=0,5.0,1=0,05\left(mol\right)\\3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\rightarrow3BaSO_4\downarrow+2Al\left(OH\right)_3\downarrow\\ \)
TH1: Nếu Al(OH)3 không bị hoà tan
\(\Rightarrow m_{kt}=m_{BaSO_4}+m_{Al\left(OH\right)_3}=233.0,05+78.\dfrac{2}{3}.0,05=14,25>10,045\left(loại\right)\)
TH2: Nếu Al(OH)3 bị hoà tan hoàn toàn.
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\rightarrow Ba\left(AlO_2\right)_2+4H_2O\)
=> \(m_{kt}=m_{BaSO_4}=233.0,05=11,65\left(g\right)< 12,045\left(g\right)\left(loại\right)\)
TH3: Kết tủa bị hoà tan 1 phần
Đặt:
\(n_{Al_2\left(SO_4\right)_3}=a\left(mol\right)\Rightarrow n_{Al^{3+}}=2a\left(mol\right);n_{SO_4^{2-}}=3a\left(mol\right)\\ n_{OH^-}=4.n_{Al^{3+}}-n_{\downarrow}\\ \Leftrightarrow0,1.2.0,5=4.2a-n_{\downarrow}\\ \Leftrightarrow n_{\downarrow}=8a-0,1\\ n_{BaSO_4}=3a\\ m_{\downarrow}=12,045\\ \Leftrightarrow\left(8a-0,1\right).78+3a.233=12,045\\ \Leftrightarrow a=0,015\left(mol\right)\\ \Rightarrow V_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,015}{0,1}=0,15\left(lít\right)\\ \Rightarrow V=150\left(ml\right)\)
Đúng 2
Bình luận (0)
Cho Al tác dụng với 200ml dung dịch axit clohiddric 1M (Ddung dịch HCL= 1,8g/ml)
A) tính thể tích khí thoát ra ở ĐKTC
B) tính Khối lượng nhôm tham gia phản ứng
C) tính nồng độ% của dung dịch muối thu được( thể tích dung dịch không thay đổi)
a.Ta có: nHCl=1.\(\frac{200}{1000}\)=0,2(mol)
Ta có phương trình 2Al + 6HCl -----> 2AlCl3 + 3H2 (1)
Theo phương trình: 2 mol 6 mol 3 mol
Theo đề: x mol 0,2 mol 0,1 mol
=> V\(H_2\)=0,1.22,4=2,24(l)
b. Từ pt (1), ta có:
mAl=x.27=\(\frac{0,2.2}{6}\).27=1,8(g)
c.Từ pt (1), ta có: mHCl=0,2. (1+35,5)=7,3(g)
mdd=\(\frac{200}{1000}.22,4.18=80,64\left(g\right)\)
=>C%=\(\frac{7,3}{80,64}.100\%=9,1\%\)
Ungr hộ nha!
Đúng 0
Bình luận (0)
cho 546g kali oxit k2O tác dụng với nước thu được 0,25 lít dung dịch bazơ A viết PTHH B tính thể tích dung dịch HCL 20%, có khối lượng riêng 1,4g/ml cần dùng để trung hòa vs dung dịch bazơ nói trên
Tính tỉ lệ thể tích dung dịch HCl 18,25% (D=1,2g/ml) và thể tích dung dịch HCl 13% (D=1,123g/ml) để pha thành dung dịch HCl 4,5 M?
Ta có công thức: \(CM=\dfrac{C\%.10D}{M}\)
CM(1) ddHCl 18,25%=\(\dfrac{18,25.10.1,2}{36,5}=6\left(M\right)\)
CM(2)ddCl 13%=\(\dfrac{13.1,123.10}{36,5}\approx4\)(M)
Gọi V1,n1,V2,n2 là thể tích và số mol của dd HCl 6M và 4M
Ta có:
n1=6V1
n2=4V2
=>\(\dfrac{6V_1+4V_2}{V_1+V_2}=4,5\Rightarrow\dfrac{V_1}{V_2}=\dfrac{1}{3}\)
Đúng 0
Bình luận (0)
gọi a , b lần lượt là thể tích của 2 chất HCL
a.,CM HCL 1 = 6M_________4.5______4.5-4
b,CM HCl 2 = 4M__________4.5______6-4.5
a/b = 0.5/1.5=1/3
Đúng 0
Bình luận (6)
Hòa tan hết 0,81 gam bột nhôm vào 550ml dung dịch HCl 0,2M thu được dung dịch A. Tính thể tích dung dịch NaOH 0,5M cần thêm vào dung dịch A để thu được lượng kết tủa lớn nhất.
A. 0,22l
B. 0.2l
C. 0,15l
D. 0,12l
Đáp án A
Số mol Al = 0.81/27= 0,03 (mol); số mol HCl = 0,55.0,2 = 0,11 (mol)
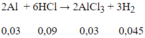
Dung dịch A thu được gồm AlCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol.
Để có lượng kết tủa lớn nhất:
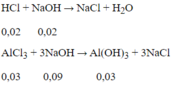
Thể tích dung dịch NaOH cần dùng
Đúng 0
Bình luận (0)
hòa tan hoàn toàn 13,2(g) hỗn hợp hai bột ZnO và Al2O3 vào 250 (ml) dung dịch HCl 2M (vừa đủ)
a) tính thành phần % theo khối lượng mỗi chất trong hỗn hợp
b) tính nồng độ mol của các muối trong dung dịch sau phản ứng (thể tích dung dịch thay đổi không đáng kể)
. Hòa tan 6,4 gam hỗn hợp gồm Mg, MgO vào dung dịch HCl 0,5M vừa đủ thu được dung dịch A và 2,24 lít khí (đktc).
a. Tính thành phần phần trăm về khối lượng của Mg, MgO trong hỗn hợp ban đầu.
b. Tính thể tích của dung dịch HCl đã dùng.
c. Tính nồng độ mol của dung dịch A.
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ MgO+2HCl\to MgCl_2+H_2O\\ \Rightarrow n_{Mg}=0,1(mol)\\ \Rightarrow \%_{Mg}=\dfrac{0,1.24}{6,4}.100\%=37,5\%\\ \Rightarrow \%_{MgO}=100\%-37,5\%=62,5\%\)
\(b,n_{MgO}=\dfrac{6,4-0,1.24}{40}=0,1(mol)\\ \Rightarrow n_{HCl}=2.0,1+2.0,1=0,4(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,4}{0,5}=0,8(l)\\ c,n_{MgCl_2}=0,1+0,1=0,2(mol)\\ \Rightarrow C_{M_{MgCl_2}}=\dfrac{0,2}{0,8}=0,25M\)
Đúng 2
Bình luận (0)
cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M
a) viết PTHH
b) tính thể tích dung dịch HCl đã dùng
\(n_{MgCO_3}=\dfrac{21}{84}=0,25\left(mol\right)\\ a.MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\\ n_{HCl}=0,25.2=0,5\left(mol\right)\\ b.V_{ddHCl}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
Đúng 2
Bình luận (0)






















