16g so3 là bao nhiêu mol của so3

Những câu hỏi liên quan
BT1: Cho 16g khi SO3. Tính
a) Số mol khí SO3?
b) Thể tích khí SO3?
c) Tính số phân tử khí SO3?
d) Cần lấy bao nhiêu gam khí N2 để thể tích N2 = 1.5 lần thể tích khí SO3?
nhầm, để sửa lại
a) nSO3 = 16/80 = 0,2 (mol)
b) VSO3 = 0,2.22,4 = 4,48 (l)
Đúng 0
Bình luận (0)
a) nSO3 = 16/32 = 0,5 (mol)
b) VSO3 = 0,5.22,4 = 11,2 (l)
Đúng 0
Bình luận (3)
c) Số phân tử của SO3 là 1
d) VN2 = 1,5.VSO3 => VN2 = 1,5.4,48 = 6,72 (l)
nN2 = 6,72/22,4 = 0,3 (mol)
=> mN2 = 0,3.28 = 8,4 (g)
Đúng 0
Bình luận (2)
Xem thêm câu trả lời
Tính khối lượng của hỗn hợp gồm 0,3 mol SO3 và 5,6 lit HCl
b) Tính thể tích của hỗn hộp gồm 0,15 mol Co2 và 16g SO2
a/ nHCl = 5,6 / 22,4 = 0,25 mol
=> mhỗn hợp = 0,3 x 80 + 0,25 x 36,5 = 33.125 gam
b/ nSO2 = 16 / 64 = 0,25 mol
=> Vhỗn hợp(đktc) = ( 0,25 + 0,15 ) x 22,4 = 8,96 lít
Đúng 0
Bình luận (0)
Trong một bình kín chứa 2 mol O2, 3 mol SO2 và một ít bột xúc tác V2O5. Nung nóng bình một thời gian thu được hỗn hợp khí B.SO2 + O2 -----V2O5,to-----SO31. Nếu hiệu suất phản ứng oxi hóa SO2 thành SO3 là 75% thì có bao nhiêu mol SO3 tạo thành?2. Nếu tổng số mol các khí trong B là 4,25. Hãy tính hiệu suất phản ứng oxi hóa SO2 thành SO3
Đọc tiếp
Trong một bình kín chứa 2 mol O2, 3 mol SO2 và một ít bột xúc tác V2O5. Nung nóng bình một thời gian thu được hỗn hợp khí B.
SO2 + O2 -----V2O5,to----->SO3
1. Nếu hiệu suất phản ứng oxi hóa SO2 thành SO3 là 75% thì có bao nhiêu mol SO3 tạo thành?
2. Nếu tổng số mol các khí trong B là 4,25. Hãy tính hiệu suất phản ứng oxi hóa SO2 thành SO3
1)
Xét tỉ lệ: \(\dfrac{3}{2}< \dfrac{2}{1}\) => Hiệu suất tính theo SO2
\(n_{SO_2\left(pư\right)}=\dfrac{3.75}{100}=2,25\left(mol\right)\)
PTHH: 2SO2 + O2 -----V2O5,to-----> 2SO3
2,25--------------------->2,25
=> nSO3 = 2,25 (mol)
2) Gọi số mol SO2 pư là a (mol)
PTHH: 2SO2 + O2 -----V2O5,to-----> 2SO3
Trc pư: 3 2 0
Pư: a-->0,5a-------------------->a
Sau pư: (3-a) (2-0,5a) a
=> (3-a) + (2-0,5a) + a = 4,25
=> a = 1,5 (mol)
=> \(H=\dfrac{1,5}{3}.100\%=50\%\)
Đúng 2
Bình luận (0)
Cho 0,2 mol So3 tính
a) thể tích SO3 (đktc)
b) khối lượng SO3
c) Số phân tử SO3
a) \(V_{SO_3}=0,2.22,4=4,48\left(l\right)\)
b) \(m_{SO_3}=0,2.80=16\left(g\right)\)
c) Số phân tử SO3 = \(0,2.6.10^{23}=1,2.10^{23}\)
Đúng 1
Bình luận (0)
Có thể điều chế được bao nhiêu mol axit sunfuric khi cho 240g lưu huỳnh trioxit S O 3 tác dụng với nước?
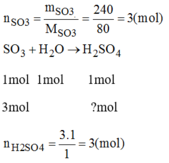
Vậy 3mol S O 3 tac dụng với H 2 O cho 3 mol H 2 S O 4
Đúng 0
Bình luận (0)
Tính khối lượng mỗ nguyên tố có trong 16g SO3
1. 0,5 mol khí SO2 có bn phân tử CO2?
2. 0,5 mol khí SO3 có bn phân tử CO2?
3.0,1 mol K có khối lượng bao nhiêu?
4. Đốt 6 gam cacbon trong không khí thu được 22 gam khí cabonic. Lượng khí oxi tham gia phản ứng là bao nhiêu?
Câu 1:
Số phân tử SO2 = \(n_{SO_2}\times N=0,5\times6\times10^{23}=3\times10^{23}\) (phân tử)
Câu 3:
MK = 1 . 39 = 39 (g/mol)
mK = nK . MK = 0,1 . 39 = 3,9 (g)
Câu 4:
PTHH: C + O2 → CO2
Áp dụng ĐLBTKL, ta có:
\(m_C+m_{O_2}=m_{CO_2}\)
\(m_C=6g\)
\(m_{CO_2}=22g\)
\(\Rightarrow6+m_{O_2}=22\)
\(m_{O_2}=22-6=16g\)
Vậy . . .
Đúng 0
Bình luận (0)
Câu 5. Cho phương trình hóa học sau SO3 + H2O H2SO4. Chất tham gia phản ứng làA.SO3, H2SO4. B. H2SO4. C. H2O, H2SO4. D. SO3, H2O.Câu 6. Đốt cháy 12,8 g bột đồng trong không khí, thu được 16g đồng (II) oxit cuo. Khối lượng của oxi tham gia phản ứng là:A nặng gấp 2 lần khí oxi. Khối lượng mol của khí A là: A. 32g B. 3,2 g. C. 6,4 g. D. 28,8 g.
Đọc tiếp
Câu 5. Cho phương trình hóa học sau SO3 + H2O H2SO4. Chất tham gia phản ứng là
A.SO3, H2SO4. B. H2SO4. C. H2O, H2SO4. D. SO3, H2O.
Câu 6. Đốt cháy 12,8 g bột đồng trong không khí, thu được 16g đồng (II) oxit cuo. Khối lượng của oxi tham gia phản ứng là:
A nặng gấp 2 lần khí oxi. Khối lượng mol của khí A là:
A. 32g B. 3,2 g. C. 6,4 g. D. 28,8 g.
Câu 5. Cho phương trình hóa học sau SO3 + H2O H2SO4. Chất tham gia phản ứng là
A.SO3, H2SO4. B. H2SO4. C. H2O, H2SO4.
Câu 6. Đốt cháy 12,8 g bột đồng trong không khí, thu được 16g đồng (II) oxit cuo. Khối lượng của oxi tham gia phản ứng là:
A. 32g B. 3,2 g. C. 6,4 g. D. 28,8 g
Bảo toàn khối lượng: \(m_{Cu}+m_{O_2}=m_{CuO}\\ \Rightarrow m_{O_2}=16-12,8=3,2\left(g\right)\)
A nặng gấp 2 lần khí oxi. Khối lượng mol của khí A là:
\(M_A=2M_{O_2}=2.32=64\left(g/mol\right)\)
Đúng 1
Bình luận (1)
a)Hãy tính số mol của:5,4g Al;16g So3; 0,8g H2 ; 3.1023phân tửH2
b) Hãy tính khối lượng của : 4,48 l (SO2)( đktc); 0,8 molCO2
c) Hãy tính thể tích : 6,6g CO2(đktc) ; 0,15 mol khí ni tơ
a) nAl= \(\frac{5,4}{27}=0,2\left(mol\right)\)
nSO3=\(\frac{16}{32+16.3}=0,2\left(mol\right)\)
nH2=\(\frac{0,8}{2}=0,4\left(mol\right)\)
nphân tử H2= (6.1023):(3.1023)=2(mol)
b) nSO2= \(\frac{4,48}{22,4}=0,2\left(mol\right)\)
=> mSO2= 0,2.(32+16.2)= 12,8(g)
mCO2= 0,8.(12+16.2)= 35,2(g)
c) nCO2=\(\frac{6,6}{44}=0,15\left(mol\right)\)
VCO2= 0,15.22,4= 3,36(l)
VN2= 0,15.22,4+3,36(l)
Sai chỗ nào ns cho mk bt nha![]()
a.
\(n_{Al}=\frac{5,4}{27}=0,2\left(mol\right)\)
\(n_{SO3}=\frac{16}{80}=0,2\left(mol\right)\)
\(n_{H2}=\frac{0,8}{2}=0,4\left(mol\right)\)
\(n_{H2}=\frac{3.10^{23}}{6,023.10^2}=0,5\left(mol\right)\)
b.
\(n_{SO2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(m_{SO2}=0,2.64=12,8\left(g\right)\)
\(m_{CO2}=0,8.44=35,2\left(g\right)\)
c.
\(n_{CO2}=\frac{6,6}{44}=0,15\left(mol\right)\)
\(V_{CO2}=0,15.22,4=3,36\left(l\right)\)
\(V_{N2}=0,15.22,4=3,36\left(l\right)\)























