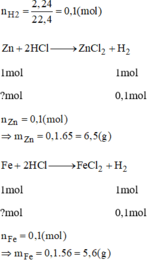Tính thể tích khí H2 ở đktc để điều chế đc khi cho: a) 13g kẽm tác dụng hết vs dung dịch H2SO4 loãng. b ) dung dịch chứa 0.1mol axit HCl tác dụng vs sắt dư

Những câu hỏi liên quan
Cho 13g zn tác dụng hết vs dung dịch axit sunfuric loãng dư thể tích của khí h2 đktc thu được là
Cho 22,4 gam sắt tác dụng với dung dịch loãng có chứa 24,5 gam axit H2SO4 . a. Tính thể tích khí H2 thu được ở (đktc). b. Chất nào dư sau phản ứng và dư bao nhiêu gam?
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right);n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe.dư\\ n_{H_2}=n_{Fe\left(p.ứ\right)}=n_{H_2SO_4}=0,25\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(g\right)\\ m_{Fe\left(dư\right)}=0,14.56=8,4\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 19.5g kẽm tác dụng vs dung dịch axit clohiđric dư. Hãy cho bt:
a) Thể tích H2 sinh ra (đktc)
b) Nếu dùng V khí H2 trên để khử 19,2g sắt (III) oxit thì thu đc tối đa bnh gam sắt
giúp mik vs đag cần gấp ![]() mik c.ơn trước
mik c.ơn trước
\(n_{Zn}=\dfrac{m}{M}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ PTHH:Zn+2HCl->ZnCl_2+H_2\)
tỉ lệ 1 ; 2 : 1 : 1
n(mol) 0,3-----0,6------->0,3------->0,3
\(V_{H_2\left(dktc\right)}=n\cdot22,4=0,3\cdot22,4=6,72\left(l\right)\)
\(PTHH:3H_2+Fe_2O_3-^{t^o}>2Fe+3H_2O\)
tỉ lệ 3 : 1 : 2 : 3
n(mol) 0,3----->0,1-------->0,2------>0,3
\(m_{Fe}=n\cdot M=0,2\cdot56=11,2\left(g\right)\)
Đúng 2
Bình luận (3)
Cho 13g kẽm tác dụng với dung dịch axit sunfuric H2SO4thu đuoc muối ZnSO4 và khí H2
A, viết ptpu
B, tính KLM axit H2SO4 pu
C, tính thể tích H2 sinh ra (đktc)
Xem chi tiết
a)
\(Zn + H_2SO_4 \to ZnSO_4 + H_2\)
b)
Theo PTHH : \(n_{H_2SO_4} = n_{H_2} = n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
\(m_{H_2SO_4} = 0,2.98 = 19,6(gam)\)
c)
\(V_{H_2} = 0,2.22,4 = 4,48(lít)\)
Đúng 3
Bình luận (1)
Câu 6: Cho 13g Kẽm tác dụng hoàn toàn với dung dịch axit clohidric
a/ Tính thể tích khí H2 sinh ra (ở đktc)? b/ Tính khối lượng ZnCl2 thu được?
c/ Dùng toàn bộ khí H2 ở trên để khử Sắt (III) oxit. Tính số gam sắt thu được?
Zn+2Hcl->ZnCl2+H2
0,2---0,4----0,2----0,2
n Zn=0,2 mol
=>VH2 =0,2.22,4=4,48l
mZncl2=0,2.136=27,2g
3H2+Fe2O3-to>2Fe+3H2O
0,2---------------------2\15
->m Fe=2\15.56=7,467g
Đúng 1
Bình luận (0)
nZn= 13/65=0,2(mol)
a) PTHH: Zn + 2 HCl -> ZnCl2 + H2
b) nH2=nZnCl2=nZn=0,2(mol)
=>V(H2,đktc)=0,2 x 22,4= 4,48(l)
c) khối lượng muối sau phản ứng chứ nhỉ?
mZnCl2=136.0,2=27,2(g)
Cho 22,4g sắt tác dụng với dung dịch loãng chứa 24,5 axit sufic a: chất nào còn dư sau phản ứng và dư bao nhiêu gam? B: tính thể tích khí hirod thu đc ở Đktc ?
a, \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Xét tỉ lệ: \(\dfrac{0,4}{1}>\dfrac{0,25}{1}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=n_{H_2SO_4}=0,25\left(mol\right)\Rightarrow n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe\left(dư\right)}=0,15.56=8,4\left(g\right)\)
b, \(n_{H_2}=n_{H_2SO_4}=0,25\left(mol\right)\Rightarrow V_{H_2}=0,25.22,4=5,6\left(l\right)\)
Đúng 4
Bình luận (1)
Người ta cho kẽm hoặc sắt tác dụng với dung dịch axit clohidric HCl để điều chế khí hidro. Nếu muốn điều chế 2,24l khí hidro (đktc) thì phải dùng số gam kẽm hoặc sắt lần lượt là:
A. 6,5g và 5,6g B. 16g và 8g
C. 13g và 11,2g D. 9,75g và 8,4g
Cho 13g kẽm tác dụng hết với 100g dung dịch axit clohiđric a%, thu được muối kẽm clorua và khí hiđro.
a. Tính a.
b. Thể tích khí hiđro thu được ở đktc và khối lượng muối tạo thành.
c. Khi cho lượng kẽm trên tác dụng với 36,5 g axit clohiđric. Tính khối lượng các chất thu được sau phản ứng
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
a) \(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
⇒ \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(C_{HCl}=\dfrac{14,6.100}{100}=14,6\)0/0
b) \(n_{H2}=\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
\(n_{ZnCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
c) \(n_{HCl}=\dfrac{36,5}{36,5}=1\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,2 1 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{1}{2}\)
⇒ Zn phản ứng hết , Hcl dư
⇒ Tính toán dựa vào số mol của Zn
\(n_{ZnCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(n_{HCl\left(dư\right)}=1-\left(0,2.2\right)=0,6\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,6.36,5=14,6\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
a, Ta có: nZn=\(\dfrac{13}{65}\)=0,2 mol
Zn + 2HCl ---> ZnCl2 + H2
Ta có: nZn=\(\dfrac{1}{2}\)nHCl => nHCl=0,1 mol
=> mHCl=0,1.36,5=3,65 g
=> a%=\(\dfrac{3,65.100}{100}\)=3,65%
b, Ta có: nZn=nZnCl2 = nH2= 0,2 mol
=> VH2=0,2.22,4=4,48 l
=> mZnCl2=0,2.136=27,2 g
c, Zn + 2HCl ---> ZnCl2 + H2
Ta có: nHCl=\(\dfrac{36.5}{36.5}\)=1 mol
Ta có: \(\dfrac{n_{HCl}}{n_{Zn}}=\dfrac{1}{0,2}\) => HCl dư tính theo Zn
Ta có: nZn=nZnCl2 = nH2= 0,2 mol
=> VH2=0,2.22,4=4,48 l
=> mZnCl2=0,2.136=27,2 g
Đúng 0
Bình luận (0)
1:cho 13g Zn tác dụng vừa đủ với dung dịch H2SO4 1M.
a,tính thể tích khí H thu được ở đktc
b,tính thể tích dung dịch HCL
2:cho Mg tác dụng vừa đủ với 200ml dung dịch HCL 2M
a,tính khối lượng Mg đã dùng
b,tính thể tích H thu được ở điều kiện tiêu chuẩn
1:
a) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
______0,2------>0,2------------------->0,2_____(mol)
=> \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b) \(V_{ddH_2SO_4}=\dfrac{0,2}{1}=0,2\left(l\right)\)
2:
a)
\(n_{HCl}=2.0,2=0,4\left(mol\right)\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
______0,2<------0,4------------------>0,2______(mol)
=> \(m_{Mg}=0,2.24=4,8\left(g\right)\)
b) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (1)