Cho 3,425 gam hỗn hợp gồm 5 oxit FeO; CuO; Al2O3; ZnO; Fe2O3 tác dụng vừa đủ với 300 ml dung dịch HCl 0,1M. Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Tính m

Những câu hỏi liên quan
Hỗn hợp A gồm FeO, Fe3O4, Fe2O3. Trong hỗn hợp A, mỗi oxit đều có 0,5 mol. Khối lượng của hỗn hợp A là
A. 231 gam. B. 232 gam.
C. 233 gam. D. 234 gam.
Có thể coi 0,5 mol FeO và 0,5 mol \(Fe_2O_3\) là 0,5 mol \(Fe_3O_4\)
Vậy cả hỗn hợp có 1 mol \(Fe_3O_4\) nên khối lượng là \(232\)g
Đúng 1
Bình luận (0)
Có thể coi 0,5 mol FeO và 0,5 mol Fe2O3Fe2O3 là 0,5 mol Fe3O4Fe3O4
Vậy cả hỗn hợp có 1 mol Fe3O4Fe3O4 nên khối lượng là 232232g
Đúng 0
Bình luận (0)
Hỗn hợp A gồm FeO, Fe3O4, Fe2O3. Trong hỗn hợp A, mỗi oxit đều có 0,5 mol. Khối lượng của hỗn hợp A là:
A. 231 gam.
B. 232 gam.
C. 233 gam.
D. 234 gam.
Chọn đáp án B.
Có thể coi 0,5 mol FeO và 0,5 mol Fe2O3 là 0,5 mol Fe3O4. Vậy cả hỗn hợp có 1 mol Fe3O4 nên có khối lượng là 232g.
Đúng 0
Bình luận (0)
Cho CO đi qua 70,25 gam hỗn hợp X gồm Fe2O3 và một oxit của kim loại R (R có hóa trị không đổi) nung nóng thu được 3,36(l) khí CO2 và hỗn hợp Y gồm Fe, Fe2O3, FeO, Fe3O4, oxit của kim loại R. Hỗn hợp Y phản ứng vừa đủ với 750ml H2SO4 1M thu được 1,12 lít khí H2và hỗn hợp Z.Thêm tiếp dung dịch NaOH từ từ cho tới dư vào hh Z, sau phản ứng hòan toàn thu được kết tủa T. Lọc T để ngoài không khí đến khối lượng không đổi thu được 101,05 gam chất rắn. Xác định CT của oxit kim loại R
Đọc tiếp
Cho CO đi qua 70,25 gam hỗn hợp X gồm Fe2O3 và một oxit của kim loại R (R có hóa trị không đổi) nung nóng thu được 3,36(l) khí CO2 và hỗn hợp Y gồm Fe, Fe2O3, FeO, Fe3O4, oxit của kim loại R. Hỗn hợp Y phản ứng vừa đủ với 750ml H2SO4 1M thu được 1,12 lít khí H2và hỗn hợp Z.Thêm tiếp dung dịch NaOH từ từ cho tới dư vào hh Z, sau phản ứng hòan toàn thu được kết tủa T. Lọc T để ngoài không khí đến khối lượng không đổi thu được 101,05 gam chất rắn. Xác định CT của oxit kim loại R

Chào bạn tuy không thể giúp bạn nhưng cho mình hỏi bạn có bị mất thanh thông báo tin nhắn như mình không ạ
Đúng 0
Bình luận (3)
Oxit kim loại R : \(R_2O_n\)
\(n_{Fe_2O_3} = a(mol) ; n_{R_2O_n} = b(mol)\\ \Rightarrow 160a + b(2R + 16n) = 70,25(1)\)
\(n_{CO} = n_{CO_2} = 0,15(mol)\)
\(CO + O_{oxit} \to CO_2\)
\(n_{O\ pư} = n_{CO_2} = 0,15(mol)\)
\(2H^+ \to H_2 + 2e\\ 2H^+ + O^{2-} \to H_2O\)
Ta có : \(n_{H^+} =2n_{H_2SO_4} = 2n_{H_2} + 2n_{O(Y)}\)
\(\Rightarrow n_{O(Y)} = 0,7(mol)\)
Bảo toàn nguyên tố với O : 3a + bn = 0,7 + 0,15 = 0,85(2)
Sau phản ứng, không thu được kim loại R,chứng tỏ R không phản ứng với CO
Mà sau khi nung T thu được khối lượng oxit lớn hơn khối lượng X ban đầu. Chứng tỏ muối sunfat của kim loại R không tan trong nước.
Vậy,101,05 gam chất rắn gồm :
\(Fe(OH)_3 : 2a(mol)\\ R_2(SO_4)_n : b(mol)\)
⇒107.2a + b(2R + 96n) = 101,05(3)
Từ (1)(2)(3) suy ra a = 0,2 ; Rb = 17,125 ; bn = 0,25
Suy ra :\(R = \dfrac{17,125}{\dfrac{0,25}{n}} = \dfrac{137}{2}n\)
Với n = 2 thì R = 137(Ba) .Vậy oxit : BaO
Đúng 2
Bình luận (4)
Cho một luồng CO dư đi qua ống sứ chứa 15,3 gam hỗn hợp gồm FeO và ZnOnung nóng, thu được một hỗn hợp chất rắn có khối lượng 12, 74 gam. Biết ZnO không bịkhử bởi CO; FeO bị khử bởi CO thu được Fe và CO2c. Tính % về khối lượng của mỗi oxit có trong hỗn hợp ban đầu?d. Để hòa tan hoàn toàn lượng chất rắn thu được sau phản ứng trên phải dùng bao nhiêugam HC
Đọc tiếp
Cho một luồng CO dư đi qua ống sứ chứa 15,3 gam hỗn hợp gồm FeO và ZnO
nung nóng, thu được một hỗn hợp chất rắn có khối lượng 12, 74 gam. Biết ZnO không bị
khử bởi CO; FeO bị khử bởi CO thu được Fe và CO2
c. Tính % về khối lượng của mỗi oxit có trong hỗn hợp ban đầu?
d. Để hòa tan hoàn toàn lượng chất rắn thu được sau phản ứng trên phải dùng bao nhiêu
gam HC
c) PTHH : FeO + CO -to--> Fe + CO2
mCR(giảm) = mO(FeO) = 15,3 - 12,74 = 2,56 (g)
=> nO(FeO) = 0,16 (mol) = nFeO
=> mFeO = 0,16.72 = 11,52 (g)
=> mZnO = 15,3 - 11,52 = 3,78 (g)
%mFeO = 11,52.100%/15,3 = 75,3%
%mZnO = 100% - 75,3% = 24,7%
d) Fe + 2HCl ----> FeCl2 + H2
ZnO + 2HCl ---> ZnCl2 + H2O
nZnO = 3,78/81=7/150 (mol)
Theo pthh : tổng nHCl = 2nFe + 2nZnO = 0,16.2 + 2.7/150 =31/75 (mol)
=> mHCl = 36,5.31/75 = 15,086 (g)
Đúng 1
Bình luận (0)
Cho 22,4 gam hỗn hợp gồm đồng 2 oxit và sắt 2 oxit feo tác dụng với 150ml dd h2so4 2m sau phản ứng thu được dụng dịch A
a) tính phần trăm về khối lượng của đồng 2 oxit và sắt 2 oxit trong hỗn hợp ban đầu
b)tính nồng độ mol các chất có trong dd A
\(a)n_{H_2SO_4}=0,15.2=0,3mol\\ FeO+H_2SO_4\rightarrow FeSO_4+H_2O\\ n_{FeO}=n_{FeSO_4}=n_{H_2SO_4}=0,3mol\\ \%m_{FeO}=\dfrac{0,3.72}{22,4}\cdot100\%=96,43\%\\ \%m_{CuO}=100\%-96,43\%=3,57\%\\ b)C_{M_{FeSO_4}}=\dfrac{0,3}{0,15}=2M\)
Đúng 0
Bình luận (0)
Khử m gam hỗn hợp X gồm các oxit CuO, FeO,
Fe
3
O
4
và
Fe
2
O
3
bằng khí CO ở nhiệt độ cao, người ta thu được 40 gam hỗn hợp chất rắn Y và 13,2 gam khí
CO
2
. Giá trị của m là A. 53,2 B. 35,2 C. 49,6 D. 44,8
Đọc tiếp
Khử m gam hỗn hợp X gồm các oxit CuO, FeO, Fe 3 O 4 và Fe 2 O 3 bằng khí CO ở nhiệt độ cao, người ta thu được 40 gam hỗn hợp chất rắn Y và 13,2 gam khí CO 2 . Giá trị của m là
A. 53,2
B. 35,2
C. 49,6
D. 44,8
Cho một luồng khí CO đi qua 0,04 mol hỗn hợp A gồm FeO và Fe2O3 ở nhiệt độ cao. Sau thí nghiệm, được hỗn hợp B gồm 4 chất rắn, cân nặng 4,784 gam và chất khí C. Dẫn C vào dung dịch Ba(OH)2 dư được 9,062 gam kết tủa.Tính khối lượng các oxit trong A. A.
m
FeO
2
,
16
g
;...
Đọc tiếp
Cho một luồng khí CO đi qua 0,04 mol hỗn hợp A gồm FeO và Fe2O3 ở nhiệt độ cao. Sau thí nghiệm, được hỗn hợp B gồm 4 chất rắn, cân nặng 4,784 gam và chất khí C. Dẫn C vào dung dịch Ba(OH)2 dư được 9,062 gam kết tủa.Tính khối lượng các oxit trong A.
A. m FeO = 2 , 16 g ; m Fe 2 O 3 = 1 , 6 g
B. m FeO = 1 , 6 g ; m Fe 2 O 3 = 2 , 16 g
C. m FeO = 4 , 78 g ; m Fe 2 O 3 = 0 , 72 g
D. m FeO = 0 , 72 g ; m Fe 2 O 3 = 4 , 8 g
Một hỗn hợp X gồm
Fe
2
O
3
, FeO và
Al
2
O
3
có khối lượng là 9,02 gam, trong đó
Al
2
O
3
chiếm 5,1 gam. Cho X phản ứng với lượng dư CO,đun nóng. Sau khi phản ứng kết thúc, ta được chất rắn Y và hỗn hợp khí gồm CO và
CO...
Đọc tiếp
Một hỗn hợp X gồm Fe 2 O 3 , FeO và Al 2 O 3 có khối lượng là 9,02 gam, trong đó Al 2 O 3 chiếm 5,1 gam. Cho X phản ứng với lượng dư CO,đun nóng. Sau khi phản ứng kết thúc, ta được chất rắn Y và hỗn hợp khí gồm CO và CO 2 . Cho hỗn hợp khí này qua nước vôi trong thu được 5 gam kết tủa. Lọc tách kết tủa, dung dịch còn lại đem đun nóng thu thêm được 1 gam kết tủa nữa. Phần trăm khối lượng của oxit sắt có phân tử khối nhỏ hơn trong hỗn hợp ban đầu gần nhất với
A. 8,00 %.
B. 35,50 %.
C. 17,70 %.
D. 16,00 %.
Chọn A
Gọi số mol của Fe 2 O 3 và FeO lần lượt là x và y (mol)
Theo bài ra: m X = 9,02 → 160x + 72y + 5,1 = 9,02 → 160x + 72y = 3,92 (1)
Cho X phản ứng với CO dư, đun nóng Al 2 O 3 không phản ứng.
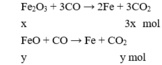
Cho hỗn hợp khí qua nước vôi trong chỉ CO 2 phản ứng
Theo bài ra:
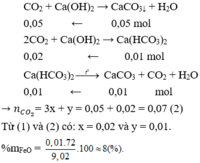
Đúng 0
Bình luận (0)
bài 1: cho 5g hỗn hợp bột oxit kim loại gồm ZnO,FeO,Fe2O3,Fe3O3,MgO tác dụng vừa hết với 200ml đ HCl 0,4M thu được dd X. Hỏi Lượng Muối trong đ X ? bài 2: cho m gam hỗn hợp các Oxit CuO,Fe2O3,ZnOtác dụng vừa đủ với 50ml đ HCl 2M. Cô cạn dung dịch sau phản ứng thu được 3,071 g muối clorua. giá trị của m là ?bài 3: oxi hoá 13,6 g hỗn hợp 2 kim loại thu được m gam hỗn hợp 2 oxit. Để hoà tan hoàn toàn m gam oxit này cần 500ml dd H2SO4 1M. Tính m
Đọc tiếp
bài 1: cho 5g hỗn hợp bột oxit kim loại gồm ZnO,FeO,Fe2O3,Fe3O3,MgO tác dụng vừa hết với 200ml đ HCl 0,4M thu được dd X. Hỏi Lượng Muối trong đ X ?
bài 2: cho m gam hỗn hợp các Oxit CuO,Fe2O3,ZnOtác dụng vừa đủ với 50ml đ HCl 2M. Cô cạn dung dịch sau phản ứng thu được 3,071 g muối clorua. giá trị của m là ?
bài 3: oxi hoá 13,6 g hỗn hợp 2 kim loại thu được m gam hỗn hợp 2 oxit. Để hoà tan hoàn toàn m gam oxit này cần 500ml dd H2SO4 1M. Tính m
Bài 1:
nHCl=0,08(mol)
nH2O=0,8/2=0,04(mol)
=>mO(trong H2O)= mO(trong oxit)=0,04. 16= 0,64(g)
=>m(Fe,Mg trong oxit)= 5 - 0,64= 4,36(g)
=> m(muối)= m(Fe,Mg) + mCl- = 4,36+ 0,08.35,5=7,2(g)
Đúng 3
Bình luận (0)
Bài 2:
nHCl=0,05.2=0,1(mol) => nCl- =0,1(mol) => mCl- = 0,1.35,5=3,55(g)
3,55> 3,071 => Em coi lại đề
Bài 3 em cũng xem lại đề hé
Đúng 1
Bình luận (0)




















