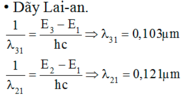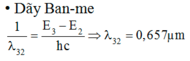Tính bậc liên kết toàn phần cho ion C3H5+, biết rằng trạng thái của electron pi được mô tả bởi 3 hàm sóng như sau:
ᴪI = 0,5ᴪ1 + 0,7071ᴪ2 + 0,5ᴪ3; ᴪII = 0,7071ᴪ1 – 0,7071ᴪ3; ᴪIII = 0,5ᴪ1 – 0,7071ᴪ2 + 0,5ᴪ3.
Tính bậc liên kết toàn phần cho ion C3H5+, biết rằng trạng thái của electron pi được mô tả bởi 3 hàm sóng như sau:
ᴪI = 0,5ᴪ1 + 0,7071ᴪ2 + 0,5ᴪ3; ᴪII = 0,7071ᴪ1 – 0,7071ᴪ3; ᴪIII = 0,5ᴪ1 – 0,7071ᴪ2 + 0,5ᴪ3.
cho t hỏi làm sao để xác định n1,n2,n3 vậy?
ở đây có 2 epi nên chỉ đủ xd ở mức nl thấp nhất nên n1=2 do hết epi nên n2,n3=0.
Hãy cho biết ứng với những giá trị nào khi electron chuyển động trong giếng thế một chiều với độ dài là a ở trạng thái n=3 sẽ đạt được giá trị cực đại và cực tiểu, cho hàm sóng = căn bậc hai (2/a)*sin(nπx/a)
a) Cho orbital nguyên tử \(\psi\)100 = e-r/\(\sqrt{\pi}\) . Hãy viết biểu thức của hàm sóng toàn phần một electron ứng với AO đã cho.
b) Hàm sóng toàn phần của hệ nhiều electron ở dạng định thức Slater đáp ứng được những yêu cầu gì?
Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide như sau:
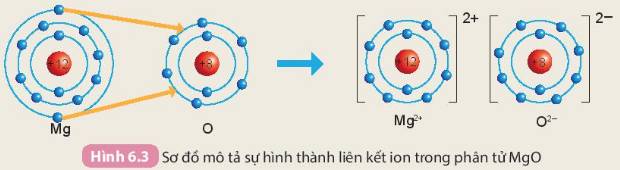
Khi hình thành phân tử `MgO,` các nguyên tử đã có sự nhường nhận `e` như sau:
`-` Nguyên tử `Mg` nhường `2e` ở lớp ngoài cùng cho nguyên tử `O` để tạo thành ion dương \(Mg^{2+}\) có vỏ bền vững giống khí hiếm `Ne`.
`-` Nguyên tử `O` nhận `2e` vào lớp ngoài cùng từ nguyên tử `Mg` để tạo thành ion âm \(O^{2-}\) có vỏ bền vừng giống khí hiếm `Ne`.
Hai ion trái dấu hút nhau, hình thành nên liên kết ion trong phân tử `MgO`.
Cho các phát biểu về vị trí và cấu tạo của kim loại như sau:
(1) Hầu hết các kim loại chỉ có từ 1e đến 3e lớp ngoài cùng
(2) Tất cả các nguyên tố nhóm B đều là kim loại
(3) Ở trạng thái rắn, đơn chất kim loại có cấu tạo tinh thể
(4) Liên kết kim loại là liên kết được hình thành do lực hút tĩnh điện giữa các ion dương kim loại và lớp electron tự do
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Giải thích:
Phát biểu đung là: (1); (2); (3); (4).
Đáp án D.
Cho các phát biểu về vị trí và cấu tạo của kim loại như sau:
(1) Hầu hết các kim loại chỉ có từ 1e đến 3e lớp ngoài cùng
(2) Tất cả các nguyên tố nhóm B đều là kim loại
(3) Ở trạng thái rắn, đơn chất kim loại có cấu tạo tinh thể
(4) Liên kết kim loại là liên kết được hình thành do lực hút tĩnh điện giữa các ion dương kim loại và lớp electron tự do
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Đáp án D.
Phát biểu đung là: (1); (2); (3); (4).
Cho các phát biểu về vị trí và cấu tạo của kim loại như sau:
(1) Hầu hết các kim loại chỉ có từ 1e đến 3e lớp ngoài cùng
(2) Tất cả các nguyên tố nhóm B đều là kim loại
(3) Ở trạng thái rắn, đơn chất kim loại có cấu tạo tinh thể
(4) Liên kết kim loại là liên kết được hình thành do lực hút tĩnh điện giữa các ion dương kim loại và lớp electron tự do
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Đáp án D.
Phát biểu đúnglà: (1); (2); (3); (4).
Viết quá trình cho hoặc nhận electron của các nguyên tử sau: Na, Mg, K, Ca, Al, F, Cl, O, N, S.
- Hãy mô tả sự hình thành liên kết ion từ các nguyên tử tương ứng trong các hợp chất sau: NaF,
Na2O, MgO, MgF2.
- Các hợp chất ion có các đặc điểm gì?
1/ Quá trình nhường - nhận electron.
\(Na^0\rightarrow Na^++e\)
\(Mg^0\rightarrow Mg^{2+}+2e\)
\(Ca^0\rightarrow Ca^{2+}+2e\)
\(F^0+e\rightarrow F^-\)
\(Cl^0+e\rightarrow Cl^-\)
\(O^0+2e\rightarrow O^{2-}\)
\(N^0+3e\rightarrow N^{3-}\)
\(S^0+2e\rightarrow S^{2-}\)
2/ Sự hình thành liên kết ion.
- Trong NaF:
+ Nguyên tử Na nhường 1e.
+ Nguyên tử F nhận 1e.
+ Nguyên tử Na và F tích điện trái dấu nên chúng hút nhau tạo thành phân tử NaF.
- Na2O, MgO, MgF2 giải thích tương tự.
3/ Đặc điểm của các hợp chất ion:
- Các hợp chất ion hầu hết là thể rắn ở nhiệt độ thường, khó tan chảy, khó bay hơi. Chẳng hạn, nhiệt độ nóng chảy của NaCl là 801 oC, nhiệt độ sôi của NaCl là 1465 oC.
- Khi các hợp chất này nóng chảy, hoặc hoà tan trong nước, lực hút tĩnh điện giữa các ion này yếu đi, kết quả là chúng phân li ra các ion trần, nên chúng dẫn điện tốt.
- Ở trạng thái rắn, các hợp chất ion không dẫn được điện.
Cho các chất sau: SiO2 là thành phần chính của thạch anh, CaCO3 là thành phần của đá vôi. Hãy cho biết chất nào được tạo nên bởi liên kết ion? Giải thích.
CaCO3 được tạo nên bởi liên kết ion.
Ca2+ + CO32- → CaCO3
Si và O đều là hai nguyên tố phi kim nên không tạo được ion trái dấu. Si và O sẽ góp chung electron để hình thành liên kết cộng hóa trị.
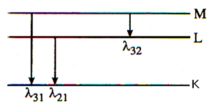
Khi kích thích nguyên tử hiđrô ở trạng thái cơ bản, bán kính quỹ đạo dừng của electron tăng lên 9 lần. Tính các bước sóng của các bức xạ mà nguyên tử hiđrô có thể phát ra sau đó, biết rằng năng lượng của các trạng thái dừng của nguyên tử hiđrô là E n = - 13 , 6 n 2 e V với n = 1, 2,...
A. 0,103mm, 0,121μm, 0,657μm
B. 0,103mm, 0,421μm, 0,558μm
C. 0,203mm, 0,321μm, 0,517μm
D. 0,155mm, 0,421μm, 0,837μm
Đáp án: A
Nguyên tử hiđrô ở trạng thái kích thích, electron ở trạng thái dừng ứng với n2 = 9 => n = 3.
Sau đó electron trở về các lớp trong cơ thể phát ra các bức xạ có bước sóng l31, l32, l21 như hình vẽ.