Cho m gam Fe vào 100 ml dung dịch chứa Cu(NO3)2 0,10M và AgNO3 0,20M. Sau khi phản ứng kết thúc thu được dung dịch chứa hai ion kim loại và chất rắn có khối lượng là (m + 1,60) gam. Giá trị của m là:
A. 0,28.
B. 0,92.
C. 2,80.
D. 0,56.
Cho m gam Fe vào 100 ml dung dịch chứa Cu(NO3)2 0,10M và AgNO3 0,20M. Sau khi phản ứng kết thúc thu được dung dịch chứa hai ion kim loại và chất rắn có khối lượng là (m + 1,60) gam. Giá trị của m là:
A. 0,28.
B. 0,92.
C. 2,80.
D. 0,56.
Đáp án là D.
Dung dịch chứa 2 ion kim loại đó là Fe2+ và Cu2+.

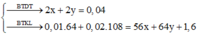

Cho m gam Fe vào 100 ml dung dịch chứa Cu(NO3)2 0,10M và AgNO3 0,20M. Sau khi phản ứng kết thúc thu được dung dịch chứa hai ion kim loại và chất rắn có khối lượng là (m + 1,60) gam. Giá trị của m là:
A. 0,28.
B. 0,92.
C. 2,80.
D. 0,56.
Đáp án là D.
Dung dịch chứa 2 ion kim loại đó là Fe2+ và Cu2+.
F e 2 + : x C u 2 + : y → → B T D T → B T K L 2 x + 2 y = 0 , 04 0 , 04 0 , 01 . 64 + 0 , 02 . 108 = 56 x + 64 y + 1 , 6 → x = 0 , 01 y = 0 , 01 → m = 0 , 56
Cho m gam Fe vào 100 ml dung dịch chứa Cu(NO3)2 0,10M và AgNO3 0,20M. Sau khi phản ứng kết thúc thu được dung dịch chứa hai ion kim loại và chất rắn có khối lượng là (m + 1,60) gam. Giá trị của m là
A. 0,28
B. 0,92
C. 2,8
D. 0,56
Câu 1: Lập PTHH
a) \(H_2+CuO-^{to}->Cu+H_2O\)
b) \(O_2+.....-^{to}->Fe_3O_4\).
c)\(Na_2SO_4+BaCl_4-->BaSO_4+NaCl\)
d)\(AgNO_3+Cu-->Cu\left(NO_3\right)_2+Ag\)
e)\(Cu\left(NO_3\right)_2+Fe-->Fe\left(NO_3\right)_2+Cu\)
Câu 2 : a) Tính nồng độ mol (lít của \(d^2\)khi hòa tan 58,5 gam NaCl vào 200ml nước (thể tích dung dịch không thay đổi )?
b)Tính \(C_M\) của \(d^2\)khi hòa tan 58,5 gam NaCl vào 200 ml nước?
Câu 3: Giải thích hiện tượng cá ngột nước (đớp ko khí )vào mùa hè?
Câu 1 :
\(a) H_2 + CuO \xrightarrow{t^o} Cu + H_2O\\ b) 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ c) BaCl_2 + Na_2SO_4 \to BaSO_4 + 2NaCl\\ d) Cu + 2AgNO_3 \to 2Ag + Cu(NO_3)_2\\ e) Fe + Cu(NO_3)_2 \to Cu + Fe(NO_3)_2\)
Câu 2 :
a)
n NaCl = 58,5/58,5 = 0,1(mol)
V dd = 200 ml = 0,2 lít
Suy ra : CM NaCl = 1/0,2 = 5M
b) Do trong mùa hè, những lúc trời nắng nóng nhiệt độ của hồ ao cao hơn bình thường vì vậy độ tan của các khí trong nước hồ ao sẽ giảm xuống và thấp hơn nồng độ của chúng trong nước, một số khí thoát ra (có oxi) nên thiếu oxi .Do đó cá ngoi lên mặt hồ đợp không khí để cung cấp oxi cho cơ thể
Câu 1 : Nung \(Cu\left(NO_3\right)_2\) thu được \(CuO\), \(NO_2\),\(O_2\).
a) Viết PTPƯ
b) Nếu có 1,5 mol \(Cu\left(NO_3\right)_2\) tham gia phản ứng thì thu được bao nhiêu gam \(CuO\) và bao nhiêu lít \(O_2\) ở đktc?
c) Muốn thu được 5,6 lít hỗn hợp 2 khí \(NO_2\)và \(O_2\) ở đktc thì phải nung bao nhiêu gam \(Cu\left(NO_3\right)_2\)?
Cho ai thanh kim loại R có hóa trị 2 có cùng khối lượng a(g)
- Nhúng thanh 1 vào dung dịch \(Cu\left(NO_3\right)_2\)
- Nhúng thanh 2 vào dung dịch \(Pb\left(NO_3\right)_2\)
Sau 1 thời gian lấy hai tanh kim loại ra rửa sạch và làm khô cân lại thấy thanh 1 giảm 0,2%, thanh 2 tăng 28,4% .Xác định thanhkim loại R
Bằng phương pháp hóa học hãy nhận biết các dung dịch sau:
a)\(HNO_3,KOH,FeSO_4,H_2SO_4\).
b)\(NaOH,FeCl_2,Ca\left(OH\right)_2,KCl.\)
c)\(Na_2SO_4,HCl,BaCl_2,FeCl_2.\)
d)\(NaNO_3,Cu\left(NO_3\right)_2,Zn\left(NO_3\right)_2,Fe\left(NO_3\right)_2\).
c, - Lẫy mỗi chất một ít làm mẫu thử và đánh số thứ tự .
- Nhúng quỳ tím vào từng dung dịch .
+, Các chất làm quỳ tím hóa đỏ là HCl, FeCl2 tạo nhóm ( I ) .
+, Các chất không làm quỳ chuyển màu là Na2SO4, BaCl2 tạo nhóm (II )
- Nhỏ từ từ dung dịch Na2SO4vào các mẫu thử ở nhóm ( II ) .
+, Mẫu tử phản ứng tạo kết tủa trắng là BaCl2 .
\(Na_2SO_4+BaCl_2\rightarrow BaSO_4+2NaCl\)
+, Mẫu thử còn lại không có hiện tượng là Na2SO4 .
- Nhỏ từ từ dung dịch NaOH dư vào các mẫu thử nhóm ( I )
+, Mẫu thử nào phản ứng không có hiện tượng là HCl .
\(NaOH+HCl\rightarrow NaCl+H_2O\)
+, Mẫu thử nào phản ứng tạo kết tủa nâu đỏ rồi hóa trắng xanh trong không khí là FeCl2 .
\(2NaOH+FeCl_2\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(4Fe\left(OH\right)_2+2H_2O+O_2\rightarrow4Fe\left(OH\right)_3\)
a, - Lấy mỗi dung dịch một ít làm mẫu thử và đánh số thứ tự .
- Nhúng quỳ tím vào từng mẫu thử .
+, Các mẫu thử làm quỳ tím hóa đỏ là : HNO3, FeSO4, H2SO4 .
+, Mẫu thử làm quỳ tím hóa xanh là : KOH .
- Nhỏ từ từ dung dịch BaCl2 dư vào từng mẫu thử còn lại .
+, Các mẫu thử phản ứng tạo kết tủa trắng là H2SO4 và FeSO4 .
\(H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\)
\(FeSO_4+BaCl_2\rightarrow FeCl_2+BaSO_4\)
+, Mẫu thử không có hiện tượng là \(HNO_3\) .
- Tiếp tục nhỏ từ từ dung dịch NaOH dư vào các mẫu thử còn lại .
+, Mẫu thử phản ứng tạo kết tủa nâu đỏ rồi hóa trắng xanh trong không khi là \(FeSO_4\) .
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
\(4Fe\left(OH\right)_2+2H_2O+O_2\rightarrow4Fe\left(OH\right)_3\)
+, Mẫu thử không có hiện tượng là H2SO4 .
b, - Lấy mỗi dung dịch một ít làm mẫu thử và đánh số thứ tự .
- Nhũng quỳ tím vào lần lượt các dung dịch .
+, Dung dịch làm quỳ tím hóa đỏ là FeCl2 .
+, Dung dịch không làm quỳ tím chuyển màu là KCl .
+, Dung dịch làm quỳ tím hóa xanh là \(NaOH,Ca\left(OH\right)_2\)
- Sục khí CO2 từ từ đến dư vào hai mẫu thử còn lại .
+, Mẫu thử hòa tan CO2 tạo kết tủa rồi tan là Ca(OH)2 .
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
\(CaCO_3+H_2O+CO_2\rightarrow CaHCO_3\)
+, Mẫu thử còn lại không có hiện tượng gì là NaOH .
. Cho 2,8 gam bột Fe và 0,81 gam Al vào 100 ml dung dịch A chứa Cu(NO3)2 và AgNO3, khuấy kỹ đến khi phản ứng kết thúc. Sau phản ứng còn lại chất rắn B gồm 3 kim loại có khối lượng 8,12 gam. Cho chất rắn B tác dụng với dung dịch HCl dư thu được 0,672 lít H2 (ở đktc). Tính nồng độ mol của từng muối trong dung dịch A.
\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(n_{Al}=\dfrac{0,81}{27}=0,03mol\)
\(B:8,12g\left\{{}\begin{matrix}Cu:a\left(mol\right)\\Ag:b\left(mol\right)\\Fe:c\left(mol\right)\end{matrix}\right.\Rightarrow64a+108b+56c=8,12\)(*)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,03 0,03
\(\Rightarrow c=n_{Fe}=0,03mol\)
Thay vào (*) ta được: \(64a+108b=8,12-0,03\cdot56\left(1\right)\)
\(n_{Fepư}=0,05-0,03=0,02mol\)
\(BTe:2n_{Cu}+n_{Ag}=3n_{Fepư}+2n_{H_2}\)
\(\Rightarrow2a+b=2\cdot0,02+3\cdot0,03\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,05\\b=0,03\end{matrix}\right.\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,05}{0,1}=0,5M\)
\(C_{M_{AgNO_3}}=\dfrac{0,03}{0,1}=0,3M\)
Viết các phương trình phản ứng sau:
\(Cu\underrightarrow{1}CuO\underrightarrow{2}CuCl_2\xrightarrow[4]{3}Cu\left(OH\right)_2\xrightarrow[6]{5}Cu\left(NO_3\right)_2\underrightarrow{7}Fe\left(NO_3\right)_2\xrightarrow[10]{9}Fe\left(OH\right)_2\)
\(\left(1\right)Cu+\dfrac{1}{2}O_2\xrightarrow[]{t^0}CuO\\ \left(2\right)CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(\left(3\right)CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl\\ \left(4\right)Cu\left(OH\right)_2+2HNO_3\rightarrow Cu\left(NO_3\right)_2+2H_2O\\ \left(5\right)Cu\left(NO_3\right)_2+Fe\rightarrow Fe\left(NO_3\right)_2+Cu\\ \left(6\right)Fe\left(NO_3\right)_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaNO_3\)
Cho hỗn hợp chứa 0,2mol Zn và 0,2 mol Fe tác dụng với dung dịch hỗn hợp \(Cu\left(NO_3\right)_2\) 2M và \(AgNO_3\) 1M.Tính m chất rắn