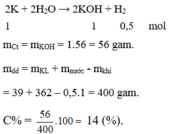
Cho x gam kim loại Kali vào 50g dd kali hidroxit 12% thu được dd có nồng độ 15% .Tìm x

Những câu hỏi liên quan
Cho 2,35 gam (kali ôxit ) K2O vào 400ml H2O. tính nồng độ dd KOH (kali hidroxit) thu được. (đs: 0,125M)
\(n_{K_2O}=\dfrac{2,35}{94}=0,025\left(mol\right)\\ K_2O+H_2O\rightarrow2KOH\\ n_{KOH}=0,025.2=0,05\left(mol\right)\\ V_{ddKOH}=V_{ddH_2O}=400\left(ml\right)=0,4\left(l\right)\\ C_{MddKOH}=\dfrac{0,05}{0,4}=0,125\left(M\right)\)
Đúng 1
Bình luận (1)
400ml = 0,4l
\(n_{K2O}=\dfrac{2,35}{94}=0,025\left(mol\right)\)
Pt : \(K_2O+H_2O\rightarrow2KOH|\)
1 1 2
0,025 0,05
\(n_{KOH}=\dfrac{0,025.2}{1}=0,05\left(mol\right)\)
\(C_{M_{ddKOH}}=\dfrac{0,05}{0,4}=0,125\left(M\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (0)
K2O+H2O->2KOH
0,025-----------0,05 mol
n K2O=2,35\94=0,025 mol
=>CmKOH=0,05\0,4=0,125M
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
hòa tan hết 9,75g kim loại kali vào 400 g dd natri hiđroxit hó nồng độ 15% tính nồng độ phần trăm chất tan trong dd thu đc
nK=0,25(mol)
2K+2H2O→2KOH+H2↑
Theo PT nKOH=nK=0,25(mol)
=> mKOH=0,25.56=14(g)
Theo PT nH2=0,5nK=0,5.0,25=0,125(mol)
=> mH2=0,125.2=0,25(g)
mdd=9,75+400−0,25=409,5(g)
mNaOH=400.15%=60(g)
C%KOH=\(\dfrac{14}{409,5}.100\)=3,419%
C%NaOH=\(\dfrac{60}{409,5}.100\)=14,652%
Đúng 1
Bình luận (0)
Bài 24: Cho một dd chứa 44,8g dd Kali hidroxit 25% tác dụng với 100ml dd axit sunfuric 1,5M thu được dd A. a. Cho quỳ tím vào dd A thì thấy có hiện tượng gi? Giải thích? b. Tính nồng độ % của dd A biết khối lượng riêng của dd axit sunfuric là 1,1g/ml
a, \(n_{KOH}=\dfrac{44,8.25\%}{56}=0,2\left(mol\right);n_{H_2SO_4}=0,1.1,5=0,15\left(mol\right)\)
PTHH: 2KOH + H2SO4 → K2SO4 + H2O
Mol: 0,2 0,1 0,1
Ta có: \(\dfrac{0,2}{2}< \dfrac{0,15}{1}\) ⇒ KOH hết, H2SO4 dư
⇒ Khi cho quỳ tím vào sẽ lm quỳ tím chuyển đỏ (vì trong dd vẫn còn axit)
b) \(m_{ddH_2SO_4}=1,1.100=110\left(g\right)\)
⇒ mdd sau pứ = 44,8 + 110 = 154,8 (g)
\(C\%_{ddK_2SO_4}=\dfrac{0,1.174.100\%}{154,8}=11,24\%\)
Đúng 0
Bình luận (0)
Hòa tan 21,1 g hỗn hợp A (gồm Kali và Kali hidroxit) vào a (gam nước),sau khi phản ứng kết thúc thu được 3,36 lít khí (đktc) và 200 gam dung dịch kiềm có nồng độ x(%).Tính a và x
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2K + 2H2O --> 2KOH + H2
0,3<-------------0,3<---0,15
=> mK = 0,3.39 = 11,7 (g)
=> mKOH(A) = 21,1 - 11,7 = 9,4 (g)
mKOH(dd sau pư) = 0,3.56 + 9,4 = 26,2 (g)
a = 200 + 0,15.2 - 21,1 = 179,2 (g)
\(C\%=\dfrac{26,2}{200}.100\%=13,1\%\) => x = 13,1
Đúng 1
Bình luận (0)
Cho 39 gam kim loại Kali vào 362 gam nước thu được dung dịch X. Nồng độ phần trăm của chất tan trong dung dịch X là
A. 10,00%.
B. 14,00%.
C. 9,75%.
D. 13,96%
Đáp án B
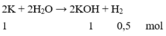
m C t = m K O H = 1.56 = 56 gam.
m d d = m K L + m n ư ớ c - m k h í = 39 + 362 – 0,5.1 = 400 gam.
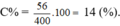
Đúng 0
Bình luận (0)
Cho 39 gam kim loại Kali vào 362 gam nước thu được dung dịch X. Nồng độ phần trăm của chất tan trong dung dịch X là
A. 10,00%.
B. 14,00%.
C. 9,75%.
D. 13,96%.
Cho dd chứa 7.4 g hidroxit vào 200ml dd HCL 1M thu được dd X chứa 11.37 gam chất tan .Kim loại tạo nên hidroxit là
\(CT:M\left(OH\right)_n\)
\(M\left(OH\right)_n+nHCl\rightarrow MCl_n+nH_2O\)
\(M+17n...........M+35.5n\)
\(7.4..........................11.37\)
\(\Leftrightarrow11.37\left(M+17n\right)=7.4\left(M+35.5n\right)\)
\(\Leftrightarrow3.97M-69.41n=0\)
\(\Leftrightarrow M=17.48n\)
\(n=3\Rightarrow M=52\)
\(CT:Cr\left(crom\right)\)
Đúng 0
Bình luận (1)
Câu6: Hoà tan hoàn toàn 17,2g hỗn hợp gồm kali và kali oxit vào 600g nước thu được 2,24 lít khí (đktc). Xác định nồng độ phần trăm của dung dịch thu được. Câu7: Làm bay hơi 60gam nước từ dd NaOH có nồng độ 15% được dd mới có nồng độ 18%
a) Hãy xác định khối lượng của dd NaOH ban đầu
b) Cho m gam natri vào dd thu được trong thí nghiệm trên được dd có nồng độ 20,37%. Tính m
Đọc tiếp
Câu6: Hoà tan hoàn toàn 17,2g hỗn hợp gồm kali và kali oxit vào 600g nước thu được 2,24 lít khí (đktc). Xác định nồng độ phần trăm của dung dịch thu được. Câu7: Làm bay hơi 60gam nước từ dd NaOH có nồng độ 15% được dd mới có nồng độ 18%
a) Hãy xác định khối lượng của dd NaOH ban đầu
b) Cho m gam natri vào dd thu được trong thí nghiệm trên được dd có nồng độ 20,37%. Tính m
Bài 1: Trung hoà 500ml dung dịch axit clohidric 0,5M bằng 200 ml dung dịch Kali hidroxit aM thu được dd muối kali clorua
A) tính a
b) tính nồng độ mol đd muối kali clorua