
Những câu hỏi liên quan
Đốt cháy hoàn toàn 0,01 mol một cacbohidrat X thu được 5,28 gam CO2 và 1,98g H2O.Tìm công thức phân tử của X, biết rằng tỉ lệ khối lượng H và O trong A là: mH : mO 0,125 :1. A. C6H10O5 B. C6H12O6 C. C12H22O11 D. C5H10O5
Đọc tiếp
Đốt cháy hoàn toàn 0,01 mol một cacbohidrat X thu được 5,28 gam CO2 và 1,98g H2O.Tìm công thức phân tử của X, biết rằng tỉ lệ khối lượng H và O trong A là: mH : mO = 0,125 :1.
A. C6H10O5
B. C6H12O6
C. C12H22O11
D. C5H10O5
Đáp án C
Hướng dẫn:
Đặt công thức phân tử của cacbohidrat X là CxHyOz
Phương trình hóa học:
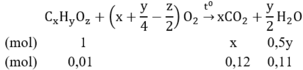
Từ lập luận trên ta có: x = 12; y = 22
Theo đề bài:
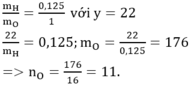
Công thức phân tử X : C12H22O11
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 9,2g một ankyl benzen A thu được 30,8g CO2. Công thức phân tử của A là: A.C6H6 B. C8H10 C. C7H8 D. C9H12
Đọc tiếp
Đốt cháy hoàn toàn 9,2g một ankyl benzen A thu được 30,8g CO2. Công thức phân tử của A là:
A.C6H6
B. C8H10
C. C7H8
D. C9H12
Đáp án C
Hướng dẫn nCO2 = 0,7 mol; MA = 13,1n => n = 7 => A là C7H8
Đúng 0
Bình luận (0)
đốt cháy hoàn toàn 11,2 lít khí A đktc,thu được 11,2 lít CO2 và 9g H2O.Tìm CTPT A biết 1 lít khí A ở đktc có khối lượng 1,34g
\(n_C = n_{CO_2}= \dfrac{11,2}{22,4} = 0,5(mol)\\ n_H = 2n_{H_2O} = 2.\dfrac{9}{18} = 1(mol)\\ n_A = \dfrac{11,2}{22,4} = 0,5(mol)\\ M_A = \dfrac{1,34}{\dfrac{1}{22,4}}=30\)
Số nguyên tử Cacbon = \(\dfrac{n_C}{n_A} = \dfrac{0,5}{0,5} = 1\)
Số nguyên tử Hidro = \(\dfrac{n_H}{n_A} = \dfrac{1}{0,5} = 2\)
Số nguyên tử Oxi = \(\dfrac{30-12-2}{16}=1\)
Vậy CTPT của A :CH2O
Đúng 1
Bình luận (0)
Đốt cháy 3 gam chất hữu cơ (A) chứa hai nguyên tố là cacbon và hiđro, thu được 5,4 gam nước. Xác định Công thức phân tử của A.Biết khối lượng mol của A là 30gam
Đặt công thức là CxHy
n H2O=\(\dfrac{5,4}{18}\)=0,3 mol
n H=2n H2O=0,6 mol
=>m C=3-0,6.1=2,4g
=>n C=\(\dfrac{2,4}{12}\)=0,2 mol
x:y=0,2:0,6=1:3
=>Vậy CTTQ =(CH3)n
mà MA=30 g\mol
=>n=\(\dfrac{30}{15}\)=2
=>CTHH:C2H6
Đúng 1
Bình luận (0)
Trắc nghiệm chắc được :V
Ta có A gồm C và H
12x + y = 30
-> x = 2 ; y = 6
=> CTHH : \(C_2H_6\)
Đúng 1
Bình luận (0)
nH = 2 . nH2O = 2 . 5,4/18 = 0,6 (mol)
nC = (3 - 0,6 . 1)/12 = 0,2 (mol)
CTHH: CxHy
=> x : y = 0,2 : 0,6 = 1 : 3
A có dạng (CH3)n
=> 15n = 30
=> n = 2
CTHH: C2H6
Đúng 0
Bình luận (0)
Đốt cháy hết m gam chất B vừa hết 0,3 mol 02 ; tạo 0,2 mol CO2 và 0,3 mol H2O.Tìm m. Tìm CTPT của B biết B chỉ chứa 1 nguyên tử O.
\(CT:C_xH_yO_z\)
Bảo toàn nguyên tố O :
\(n_{O\left(b\right)}=0.2\cdot2+0.3-0.3\cdot2=0.1\left(mol\right)\)
\(m_B=m_C+m_H+m_O=0.2\cdot12+0.3\cdot2+0.1\cdot16=4.6\left(g\right)\)
\(x:y:z=0.2:0.6:0.1=2:6:1\)
\(CT:C_2H_6O\)
Đúng 5
Bình luận (0)
nC=0,2mol
nH=0,6mol
bảo toàn ngto O
nO=2nCO2+nH2O-2nO2=2.0,2+0,3-2.0,3=0,1mol
nC:nH:nO=0,2:0,6:0,1=2:6:1
=>C2H6O
Đúng 4
Bình luận (0)
Đốt cháy hoàn toàn 3,584 lít hidrocacbon A(đktc) thu đc 14,08g CO2 và 8,64g H2O.Tìm CTPT của A
\(n_A=\dfrac{3,584}{22,4}=0,16\left(mol\right)\\ n_C=n_{CO_2}=\dfrac{14,08}{44}=0,32\left(mol\right)\\ n_H=2n_{H_2O}=2.\dfrac{8,64}{18}=0,96\left(mol\right)\)
Trong 1 mol A có: \(\left\{{}\begin{matrix}n_C=\dfrac{0,32}{0,16}=2\left(mol\right)\\n_H=\dfrac{0,96}{16}=6\left(mol\right)\end{matrix}\right.\)
=> CTHH của A là C2H6
Đúng 1
Bình luận (0)
Đốt cháy 4,6gam chất hữu cơ A thu được sản phẩm gồm 8,8 gam khí cacbonic và 5,4gam nước.
a)Hỏi trong A có ~ nguyên tố nào?
a)Xác định CPU của A,biết tỉ khối hơi của A số với hiđro là 23.
c)A có hàm gia pu với oxi,clo,brom không ?Viết phương trình nếu có.
Xem chi tiết
a, Vì đốt cháy A thu được CO2 và H2O nên A có C và H, có thể có O.
Ta có: \(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
Có: mC + mH = 0,2.12 + 0,6.1 = 3 (g) < mA
⇒ A gồm các nguyên tố C, H và O.
b, Có: mO = 4,6 - 3 = 1,6 (g)
\(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Giả sử CTPT của A là: CxHyOz (x, y, z nguyên dương).
⇒ x : y : z = 0,2 : 0,6 : 0,1 = 2 : 6 : 1
⇒ CTĐGN của A là (C2H6O)n. (n nguyên dương)
Mà: MA = 23.2 = 46 (g/mol)
\(\Rightarrow n=\dfrac{46}{12.2+6+16}=1\left(tm\right)\)
Vậy: A là C2H6O.
c, PT: \(C_2H_6O+3O_2\underrightarrow{t^o}2CO_2+3H_2O\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Câu 3:
a, Đốt cháy 5,6 g chất hữu cơ A, thu được 13,2 g CO2 và 3,6 g H2O. Lập CTPT của A biết tỉ khối của A so với khí nitơ bằng 2.
b, Đốt cháy 3 gam chất hữu cơ A, thu được 8,8 gam CO2 và 5,4 gam H2O. Tìm công thức phân tử của A.Biết tỉ khối hơi của A so với H2 bằng 15
1, Bảo toàn khối lượng: mO2 = mCO2 + mH2O – mA = 11,2 g
=> nO2 = 11,2 /32 = 0,35 mol
nCO2 = 0,3 mol, nH2O = 0,2 mol
Bảo toàn nguyên tố: nC(A) = nC(CO2) = nCO2 =0,3 mol
nH(A) = nH(H2O) = 2nH2O =0,4 mol
nO(A) = nO(H2O) + nO(CO2) – nO(O2)= 0,3.2+0,2 -0,35.2= 0,1 mol
Gọi CTPT của A là CxHyOz
=> x : y : z = nC(A) : nH(A) : nO(A) = 3 : 4 : 1
=> CT tối giản của A là C3H4O => CTPT A có dạng (C3H4O)n
MA = 14.2.2=56 => n = 1
Vậy CTPT của A là C3H4O
Đúng 2
Bình luận (0)
b/ n CO2 = 8,8 : 44 = 0,2 mol => m c = 0,2 x 12 = 2,4( g)
n H2O = 5,4 : 18 = 0,3 mol => mH = 0,3 x 2 = 0,6 (g)
Khối lượng của C và H trong A là : 2,4 + 0,6 = 3 (g)
A chỉ chứa hai nguyên tố là C và H
b/ Công thức của A là CxHy ta có:
x ; y = ( mc ; 12) : ( mH : 1) = ( 2,4 : 12) : ( 0,6 : 1) = 1 : 3
Công thức phân tử của A có dạng ( CH3) n . Vì MA =15.2
=> 15 n =30
Nếu n = 1 không đảm bảo hoá trị C
Nếu n = 2 Công thức phân tử của A là C2H6
Đúng 1
Bình luận (0)
a, nC = 13,2/44 = 0,3 (mol)
nH = 2 . 3,6/18 = 0,4 (mol)
nO = (5,6 - 12 . 0,3 - 0,4)/16 = 0,1 (mol)
CTPT: CxHyOz
=> x : y : z = 0,3 : 0,4 : 0,1 = 3 : 4 : 1
=> (C3H4O) = 28 . 2 = 56 (g/mol)
=> n = 1
CTPT: C3H4O
b, nC = 8,8/44 = 0,2 (mol)
nH = 2 . 5,4/18 = 0,6 (mol)
Xét mC + mH = 0,2 . 12 + 0,6 = 3
=> A chỉ có C và H
CTPT: CxHy
=> x : y = 0,2 : 0,6 = 1 : 3
=> (CH3)n = 15 . 2 = 30 (g/mol)
=> n = 2
CTPT: C2H6
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 4,3 g một chất A(phân tử chỉ chứa C,H,O ) thu được sản phẩm cháy gồm 8,8 gam khí cacbônic và 2,7 gam nước. 1) tính phần trăm của các nguyên tố có trong x 2) xác định công thức phân tử của A biết tỉ khối hơi của A so với H2 là 43
1)
\(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{2,7}{18}=0,15\left(mol\right)\)
Bảo toàn C: nC = 0,2 (mol)
Bảo toàn H: nH = 0,3 (mol)
\(\left\{{}\begin{matrix}\%C=\dfrac{0,2.12}{4,3}.100\%=55,81\%\\\%H=\dfrac{0,3.1}{4,3}=6,97\%\\\%O=100\%-55,81\%-6,97\%=37,22\%\end{matrix}\right.\)
2)
\(n_O=\dfrac{4,3-0,2.12-0,3}{16}=0,1\left(mol\right)\)
nC : nH : nO = 0,2 : 0,3 : 0,1 = 2:3:1
=> CTPT: (C2H3O)n
Mà M = 43.2 = 86 (g/mol)
=> n = 2
=> CTPT: C4H6O2
Đúng 1
Bình luận (0)





















