Bài 2: Một hợp chất tạo bởi nguyên tố sắt và lưu huỳnh.Tìm CTHH đơn giản của hợp chất biết sắt kết hợp với lưu huỳnh theo tỉ lệ khối lượng 7: 8.
Bài 2: Một hợp chất tạo bởi nguyên tố sắt và lưu huỳnh.Tìm CTHH đơn giản của hợp chất biết sắt kết hợp với lưu huỳnh theo tỉ lệ khối lượng 7: 8.
Gọi CT của hợp chất: FexSy
Ta có: \(\dfrac{m_{Fe}}{m_S}=\dfrac{56x}{32y}=\dfrac{7}{8}\\ \Rightarrow\dfrac{x}{y}=\dfrac{1}{2}\)
=> CTHH đơn giản: FeS2
\(CTTQ:Fe_xS_y\\ \Rightarrow\dfrac{m_{Fe}}{m_S}=\dfrac{56x}{32y}=\dfrac{7}{8}\\ \Rightarrow\dfrac{x}{y}=\dfrac{7}{8}\cdot\dfrac{32}{56}=\dfrac{1}{2}\\ \Rightarrow x=1;y=2\\ \Rightarrow FeS_2\)
đốt nóng hỗn hợp bột magie và lưu huỳnh thu được hợp chất là magie sunfua .Biết 2 nguyên tố kết hợp với nhau theo tỉ lệ khối lượng 3 phần magie với 4 lưu huỳnh
a) Tìm công thứ hóa học đơn giản của magie sunfua
b) Trộn 8 g magie với 8 g lưu huỳnh rồi đốt nóng . Khối lượng các chất sau phản ứng là
A 7 g magie sufua
B 7 g magie sunfua và 8 g lưu huỳnh
C 16 g magie sunfua
D 14 g magie sunfua và 2 g magie
B
a) CTTQ MgxSy (x,y: nguyên, dương)
Ta có: mMg/ mS= 3/4
<=> 24x/32y=3/4
<=>x/y=1/1
=> CTHH đơn giản: MgS
b) nMg= 1/3 (mol)
nS= 0,25(mol)
PTHH: Mg + S -to-> MgS
Ta có: 1/3 : 1 > 0,25/1
=> Mg dư, S hết, tính theo nS
=> nMgS=0,25(mol) -> mMgS= 56.0,25=14(g)
mMg(dư)= 8 - 0,25.24=2(g)
=> Chọn D
Đốt nóng hỗn hợp bột magie và lưu huỳnh, thu được hợp chất là magie sunfua. Biết 2 nguyên tố kết hợp với nhau theo tỉ lệ khối lượng là 3 phần magie với 4 phần lưu huỳnh. Tìm công thức hóa học đơn giản của magie sunfua.
Giả sử hợp chất có khối lượng 7g → m M g = 3g ; m S = 4g
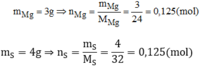
Vậy trong hợp chất: 0,125 mol nguyên tử Mg và 0,125 mol nguyên tử S. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử S.
Nên công thức hóa học đơn giản của magie sunfua: MgS.
Đốt nóng hỗn hợp bột Fe và S thu được hợp chất sắt Sunfua. Biết hai nguyên tố này kết hợp với nhau theo tỉ khối là 7 phần sắt và 4 phần lưu huỳnh. Tìm công thức hóa học đơn giản của sắt sunfua.
Gọi CTHHTQ của hc sắt sunfua là FexSy
Ta có :
\(\dfrac{mFe}{mS}=\dfrac{7}{4}< =>\dfrac{56x}{32y}=\dfrac{7}{4}< =>\dfrac{x}{y}=\dfrac{56.4}{32.7}=\dfrac{1}{1}\)
=> CTHH là FeS
Lập CTHH của hợp chất gồm Magiê và lưu huỳnh biết 2 nguyên tố này kết hợp với nhau theo tỉ lệ khối lượng là 3 phần Magie và 4 phần lưu huỳnh.
Goi CT chung là MgxS2.
Ta có pt \(\dfrac{24x}{32\cdot2}=\dfrac{3}{4}\)
Suy ra x = 32*2*3 /4 /24 = 2
Vậy suy ra CT là MgS.
Một hợp chất của lưu huỳnh có thành phần gồm 7 phần khối lượng
sắt và 4 phần khối lượng lưu huỳnh. CTHH đơn giản nhất của hợp chất đó là?
Gọi CTHH cần tìm là: FexOy
\(\dfrac{56x}{32y}=\dfrac{7}{4}\Rightarrow\dfrac{x}{y}=\dfrac{7}{4}.\dfrac{32}{56}=\dfrac{1}{1}\)
\(\Rightarrow\left\{{}\begin{matrix}x=1\\y=1\end{matrix}\right.\\ CTHH:FeS\)
1,10g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28g bột lưu huỳnh.
Tính tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu, theo:
- lượng chất.
- khối lượng chất.
Gọi nFe = x mol, theo PT ⇒ nS (1) = nFe = x mol
Gọi nAl = y mol, theo PT ⇒ nS (2) = 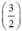 . nAl =
. nAl = 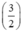 . y mol
. y mol
⇒ nS = x + 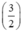 . y = 0,04 mol.
. y = 0,04 mol.
mhh = 56x + 27y = 1,1.
Giải hệ phương trình ta có x = 0,01 mol, y= 0,02 mol.
Tỉ lệ % sắt và nhôm trong hỗn hợp theo lượng chất ( theo số mol là):
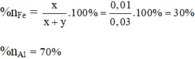
Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp theo khối lượng chất:
mAl = 0,02 x 27 = 0,54g
mFe = 0,01 x 56 = 0,56g.
%mAl = 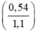 × 100% = 49,09%
× 100% = 49,09%
%mFe = 100% - 49,09% = 50,91%
Phân tử một hợp chất được tạo bởi 1 nguyên tử nguyên tố T liên kết với a nguyên tử lưu huỳnh và nặng gấp 3,75 lần phân tử oxi. Trong hợp chất này, T chiếm 46,67% về khối lượng.Tìm cthh của hợp chất
CTHH: TSa
\(M_{TS_a}=3,75.32=120\left(g/mol\right)\)
\(\%T=\dfrac{M_T}{120}.100\%=46,67\%\)
=> MT = 56 (g/mol)
=> T là Fe
a = 2
=> CTHH: FeS2
Hợp chất A tạo bởi Mg(II) và PO\(_4\)(III); hợp chất B tạo bởi 2 nguyên tố là lưu huỳnh và oxi, biết tỉ lệ theo khối lượng của lưu huỳnh và oxi là 2:3;M\(_B\)=80g/mol. Hãy:
a)Lập CTHH của A,B
b)Tính thành phần % về khối lượng của nguyên tố oxi có trong hợp chất A và B