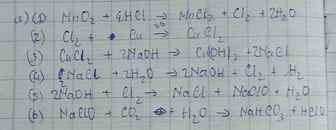Những câu hỏi liên quan
Câu 7. Hoàn thành chuỗi phản ứng sau:a)MnO2 ® Cl2 ® HCl ® Cl2 ® CaCl2 ® Ca(OH)2 ®Clorua vôib) KMnO4 ® Cl2 ® KCl ® Cl2 ® axit hipoclorơ ® NaClO ® NaCl ® Cl2 ® FeCl3 ® HClO ® HCl ® NaClc) Cl2 ® Br2 ® I2 ® HCl ® FeCl2 ® Fe(OH)2
Đọc tiếp
Câu 7. Hoàn thành chuỗi phản ứng sau:
a)MnO2 ® Cl2 ® HCl ® Cl2 ® CaCl2 ® Ca(OH)2 ®Clorua vôi
![]() b) KMnO4 ® Cl2 ® KCl ® Cl2 ® axit hipoclorơ
b) KMnO4 ® Cl2 ® KCl ® Cl2 ® axit hipoclorơ
® NaClO ® NaCl ® Cl2 ® FeCl3
![]() ® HClO ® HCl ® NaCl
® HClO ® HCl ® NaCl
![]() c) Cl2 ® Br2 ® I2
c) Cl2 ® Br2 ® I2
® HCl ® FeCl2 ® Fe(OH)2
Hoàn thành phương trình phản ứng theo chuỗi biên hóa sau (ghi rõ đk nếu có)
a/ MnO2 Cl2→ CuCl2→ NaCl →NAOH → NaClO -→ HC1O
b/ KMNO4→ Cl2→ HCl → KCI → KOH → KCI → Cl2→ FeCl3→ Fe(N03)3
c/ Cl2→ NaCl → AgCl → Cl2→ NaClO –→ Cl2→ CaOCl2
d/ H2 HCl - FeCl2 FeCl3→NaCl → HCI → CaCl2→ CACO3
$a) MnO_2 + 4HCl \xrightarrow{t^o} MnCl_2 + Cl_2 + 2H_2O$
$Cl_2 + Cu \xrightarrow{t^o} CuCl_2$
$CuCl_2 + 2NaOH \to Cu(OH)_2 + 2NaCl$
$2NaCl + 2H_2O \xrightarrow{đpdd, cmn} 2NaOH + H_2 + Cl_2$
$2NaOH + Cl_2 \to NaCl + NaClO + H_2O$
$NaClO + HCl \to NaCl + HClO$
b)
$2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O$
$Cl_2 + H_2 \xrightarrow{ánh\ sáng} 2HCl$
$HCl + KOH \to KCl + H_2O$
$2KCl + 2H_2O \xrightarrow{đpdd, cmn} 2KOH + H_2 + Cl_2$
$3Cl_2 + 2Fe \xrightarrow{t^o} 2FeCl_3$
$FeCl_3 + 3AgNO_3 \to Fe(NO_3)_3 + 3AgCl$
Đúng 6
Bình luận (4)
Câu 1: Viết các phương trình phản ứng xảy ra cho các sơ đồ sau:
a) HCl → Cl₂ → FeCl3 → NaCl → HCl
b) KMnO4 → Cl2 → HCl → FeCl3 → AgCl
c) MnO2→ Cl2 -> HCl → FeCl2 →AgCl
d) Cl₂→ KClO3 → KCI → Cl2 → CaCl2
e) KMnO4→ Cl2 → KClO3 → KCl → Cl₂
g) KI→ 12→ HI→ HCI→ KCI mọi người giúp em với ạ 🥰
a)
\(4HCl+MnO_2\rightarrow MnCl_2+Cl_2+2H_2O\\ 3Cl_2+2Fe\xrightarrow[]{t^o}2FeCl_3\\ FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaCl\\ 2NaCl+H_2SO_{4\left(\text{đ}\right)}\xrightarrow[]{t^o}Na_2SO_4+2HCl\)
b)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\\ Cl_2+H_2\xrightarrow[]{a/s}2HCl\\ 6HCl+Fe_2O_3\rightarrow2FeCl_3+3H_2O\\ FeCl_3+3AgNO_3\rightarrow Fe\left(NO_3\right)_3+3AgCl\)
c)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\\ Cl_2+H_2\xrightarrow[]{a/s}2HCl\\ 2HCl+Fe\rightarrow FeCl_2+H_2\\ FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\)
d)
\(3Cl_2+6KOH_{\left(\text{đ}\text{ặ}c\right)}\xrightarrow[]{t^o}5KCl+KClO_3+3H_2O\\ 2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\\ 2KCl\xrightarrow[]{\text{đ}pnc}2K+Cl_2\\ Cl_2+Ca\xrightarrow[]{t^o}CaCl_2\)
e)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\\ 3Cl_2+6KOH_{\left(\text{đ}\text{ặ}c\right)}\xrightarrow[]{t^o}5KCl+KClO_3+3H_2O\\ 2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\\ 2KCl\xrightarrow[]{\text{đ}pnc}2K+Cl_2\)
g)
\(2KI+O_3+H_2O\rightarrow2KOH+I_2+O_2\\ I_2+H_2\xrightarrow[]{t^o,p,xt}2HI\\ 2HI+Cl_2\rightarrow2HCl+I_2\\ KOH+HCl\rightarrow KCl+H_2O\)
Đúng 5
Bình luận (3)
Mn giúp mk với ạ
Viết các phương trình phản ứng xảy ra cho các sơ đồ sau:
a) HCl Cl2 FeCl3 NaCl HCl CuCl2 AgCl
b) KMnO4Cl2HCl FeCl3AgCl Cl2Br2I2ZnI2 Zn(OH)2
c) MnO2 → Cl2 → KClO3 → KCl → HCl → Cl2 → Clorua vôi
d) Cl2KClO3KClCl2Ca(ClO)2CaCl2Cl2O2
e) KMnO4 Cl2 KClO3 KCl Cl2 HCl FeCl2 FeCl3 Fe(OH)3
f) CaCl2 NaCl HCl Cl2 CaOCl2 CaCO3 CaCl2 NaCl NaClO
Đọc tiếp
Mn giúp mk với ạ
Viết các phương trình phản ứng xảy ra cho các sơ đồ sau:
a) HCl Cl2 FeCl3 NaCl HCl CuCl2 AgCl
b) KMnO4Cl2HCl FeCl3AgCl Cl2Br2I2ZnI2 Zn(OH)2
c) MnO2 → Cl2 → KClO3 → KCl → HCl → Cl2 → Clorua vôi
d) Cl2KClO3KClCl2Ca(ClO)2CaCl2Cl2O2
e) KMnO4 Cl2 KClO3 KCl Cl2 HCl FeCl2 FeCl3 Fe(OH)3
f) CaCl2 NaCl HCl Cl2 CaOCl2 CaCO3 CaCl2 NaCl NaClO
4HCl+MnO2-->MnCl2+2H2O+Cl2
3Cl2+2Fe-->2FeCl3
FeCl3+3NaOH-->3NaCl+Fe(OH)3
2NaCl+H2SO4-->Na2SO4+2HCl
2HCl+Cuo-->CuCl2+H2O
CuCl2+2AgNO3-->2AgCl+Cu(NO3)2

 3)
3)
3Cl2+6KOH→3H2O+5KCl+KClO3
2KClO3→2KCl+3O2
2KCl+H2SO4→K2SO4+2HCl
16HCl+2KMnO4→5Cl2+8H2O+2KCl+2MnCl2
2Ca(OH)2+2Cl2→2H2O+CaCl2+Ca(ClO)2 e)a. 2KMnO4 + 16HCl (đ) -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O (Đ.C Cl2)
Cl2 + KOH -> KCl + KClO3 + H2O
2KClO3 -> 2KCl + 3O2 (đ/c khí O2 lớp 8)
2KCl -> 2K + Cl2
Cl2 + H2O ->HCl + HClO
2HCl + Fe -> FeCl2 + H2
2FeCl2 + Cl2 -> 2FeCl3
FeCl3 + NaOH -> Fe(OH)3 + NaCl
Câu 1: viết các phương trình phản ứng xảy ra cho các sơ đồ sau
a,HCl→Cl2→FeCl3→NaCl→HCl→CuCl2→AgCl
b,KMnO4→Cl2→HCl→FeCl3→AgCl→Cl2→Br2→I2→ZnI2→Zn(OH)2
c,MnO2→Cl2→KClO3→KCl→HCl→Cl2→Clorua vôi
a)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\)
\(2NaCl+H_2SO_4\underrightarrow{t^o}Na_2SO_4+2HCl\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2AgCl\downarrow\)
b)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(H_2+Cl_2\underrightarrow{t^o}2HCl\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(FeCl_3+3AgNO_3\rightarrow Fe\left(NO_3\right)_3+3AgCl\downarrow\)
\(2AgCl\underrightarrow{as}2Ag+Cl_2\)
\(2NaBr+Cl_2\rightarrow2NaCl+Br_2\)
\(2NaI+Br_2\rightarrow2NaBr+I_2\)
\(Zn+I_2\underrightarrow{H_2O}ZnI_2\)
\(ZnI_2+2NaOH\rightarrow2NaI+Zn\left(OH\right)_2\)
c)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(3Cl_2+6KOH\underrightarrow{t^o}5KCl+KClO_3+3H_2O\)
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(2KCl+H_2SO_4\underrightarrow{t^o}K_2SO_4+2HCl\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(Ca\left(OH\right)_2+Cl_2\rightarrow CaOCl_2+H_2O\)
Đúng 2
Bình luận (0)
Câu 1: viết các phương trình phản ứng xảy ra cho các sơ đồ saua,HCl→Cl2→FeCl3→NaCl→HCl→CuCl2→AgClb,KMnO4→Cl2→HCl→FeCl3→AgCl→Cl2→Br2→I2→ZnI2→Zn(OH)2c,MnO2→Cl2→KClO3→KCl→HCl→Cl2→Clorua vôiCâu 2: Nhận biết các dạng dung dịch mất nhãn sau bằng phương pháp hóa học :NaCl,NaBr,NaI,HCl,H2SO4,NaOH.Câu 3: Cho 31,6 g KMnO4 tác dụng với dung dịch HCl dư sẽ thu được bao nhiêu lít Cl2(ở đktc) nếu H của phản ứng là 75 %Câu 4: Cho 8,3 gam hỗn hợp Al,Fe,Mg tác dụng hết với dung dịch HCl vừa đủ .Sau phản ứng khối...
Đọc tiếp
Câu 1: viết các phương trình phản ứng xảy ra cho các sơ đồ sau
a,HCl→Cl2→FeCl3→NaCl→HCl→CuCl2→AgCl
b,KMnO4→Cl2→HCl→FeCl3→AgCl→Cl2→Br2→I2→ZnI2→Zn(OH)2
c,MnO2→Cl2→KClO3→KCl→HCl→Cl2→Clorua vôi
Câu 2: Nhận biết các dạng dung dịch mất nhãn sau bằng phương pháp hóa học :NaCl,NaBr,NaI,HCl,H2SO4,NaOH.
Câu 3: Cho 31,6 g KMnO4 tác dụng với dung dịch HCl dư sẽ thu được bao nhiêu lít Cl2(ở đktc) nếu H của phản ứng là 75 %
Câu 4: Cho 8,3 gam hỗn hợp Al,Fe,Mg tác dụng hết với dung dịch HCl vừa đủ .Sau phản ứng khối lượng dung dịch HCl tăng thêm 7,8 gam . Tính khối lượng muối thu được.
Câu 5: Hỗn hợp khí X gồm o6zon và oxi có tỉ khối đối với hidro bằng 17,2. Tính phần trăm theo thể tích mỗi khí trong hỗn hợp X.
Câu 6:Cho 9 gam hỗn hợp gồm Al và Cu tác dụng với lượng dư dung dịch HCl nồng độ 20% . Sau phản ứng thu được 1,344 lít khí (ở đktc).
a, Tính % về khối lượng các kim loại trong hỗn hợp ban đầu
b,Tính khối lượng dung dịch HCl đã dùng . Biết rằng lượng dung dịch HCl đã dùng được lấy dư 10% so với lượng cần thiết cho phản ứng.
tách nhỏ ra bạn nhé, 1 lần bạn đăng 1 câu thôi nhé!
Đúng 0
Bình luận (2)
Mình làm câu 2 nhé:
Cho thử quỳ tím:
- Quỳ tím chuyển đỏ -> H2SO4, HCl (1)
- Quỳ tím chuyển xanh -> NaOH
- Quỳ tím không đổi màu -> NaCl, NaI, NaBr (2)
Cho lần lượt các chất (1) tác dụng với BaCl2:
- Xuất hiện kết tủa trắng -> H2SO4
BaCl2 + H2SO4 -> BaSO4 + 2HCl
- Không hiện tượng -> HCl
Cho lần lượt các chất (2) tác dụng với AgNO3:
- Kết tủa màu trắng -> AgCl
NaCl + AgNO3 -> AgCl + NaNO3
- Kết tủa màu vàng nhạt -> NaBr
NaBr + AgNO3 -> NaNO3 + AgBr
Kết tủa màu vàng đậm -> NaI
NaI + AgNO3 -> AgI + NaNO3
Đúng 2
Bình luận (2)
a. NaCl → Cl2 → FeCl3 → NaCl → HCl → CuCl2 → AgCl.b. CaCO3 → CaCl2 → NaCl → NaOH → NaClO → NaCl → Cl2 → FeCl3 → AgClc. KMnO4 → Cl2 → KClO3 → KCl → HCl → CuCl2 → AgCl → Cl2 → clorua vôid. Cl2 → KClO3 → KCl → Cl2 → HCl → FeCl2 → FeCl3 → PbCl2.
Đọc tiếp
a. NaCl → Cl2 → FeCl3 → NaCl → HCl → CuCl2 → AgCl.
b. CaCO3 → CaCl2 → NaCl → NaOH → NaClO → NaCl → Cl2 → FeCl3 → AgCl
c. KMnO4 → Cl2 → KClO3 → KCl → HCl → CuCl2 → AgCl → Cl2 → clorua vôi
d. Cl2 → KClO3 → KCl → Cl2 → HCl → FeCl2 → FeCl3 → PbCl2.
a. NaCl → Cl2 → FeCl3 → NaCl → HCl → CuCl2 → AgCl.
2NaCl+2H2O-đp\mn->2NaOH+H2+Cl2
3Cl2+2Fe-to>2FeCl3
FeCl3+3NaOH->3NaCl+Fe(OH)3
2NaCl+H2SO4-to>Na2SO4+2HCl
2HCl+CuO->CuCl2+H2O
CuCl2+2AgNO3->2AgCl+Cu(NO3)2
Đúng 3
Bình luận (0)
b. CaCO3 → CaCl2 → NaCl → NaOH → NaClO → NaCl → Cl2 → FeCl3 → AgCl
CaCO3+2HCl->CaCl2+H2O+CO2
CaCl2+Na2CO3->2NaCl+CaCO3
2NaCl+2H2o-đp->2NaOH+Cl2+H2
2NaOH+Cl2-to>NaCl+NaClO+H2O
2NaClO-to->2NaCl+O2
2NaCl+2H2O-đp\mn->2NaOH+H2+Cl2
3Cl2+2Fe-to>2FeCl3
FeCl3+3AgNO3->3AgCl+Fe(NO3)3
Đúng 1
Bình luận (0)
Bài 1: Hoàn thành các phương trình phản ứng hóa học theo sơ đồ chuyển hóa sau:
1. MnO2 → Cl2 → HCl → NaCl → Cl2 → H2SO4 → HCl
2. KMnO4 → Cl2 → KClO3 → Cl2 → FeCl3 → KCl → KOH
3. BaCl2 → Cl2 → HCl → FeCl2 → FeCl3 → BaCl2 → HCl
4. C2H2 → HCl → CuCl2 → KCl → KOH → KClO3 → Cl2
5. HCl → Cl2 → FeCl3 → NaCl → HCl → CuCl2 → AgCl
6. NaCl → HCl → Cl2 → KClO3 → KCl → Cl2 → CaOCl2
Đọc tiếp
Bài 1: Hoàn thành các phương trình phản ứng hóa học theo sơ đồ chuyển hóa sau:
1. MnO2 → Cl2 → HCl → NaCl → Cl2 → H2SO4 → HCl
2. KMnO4 → Cl2 → KClO3 → Cl2 → FeCl3 → KCl → KOH
3. BaCl2 → Cl2 → HCl → FeCl2 → FeCl3 → BaCl2 → HCl
4. C2H2 → HCl → CuCl2 → KCl → KOH → KClO3 → Cl2
5. HCl → Cl2 → FeCl3 → NaCl → HCl → CuCl2 → AgCl
6. NaCl → HCl → Cl2 → KClO3 → KCl → Cl2 → CaOCl2
1.
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(H_2+Cl_2\underrightarrow{^{as}}2HCl\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(2NaCl\underrightarrow{^{đpnc}}2Na+Cl_2\)
\(4Cl_2+H_2S+4H_2O\rightarrow8HCl+H_2SO_4\)
\(NaCl+H_2SO_4\rightarrow NaHSO_4+HCl\)
2.
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(6KOH+3Cl_2\rightarrow5KCl+KClO_3+3H_2O\)
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
\(Fe+\frac{3}{2}Cl_2\underrightarrow{^{to}}FeCl_3\)
\(FeCl_3+3KOH\rightarrow Fe\left(OH\right)_3+3KCl\)
\(2KCl+2H_2O\underrightarrow{^{đpmn}}2KOH+Cl_2+H_2\)
3.
\(BaCl_2\underrightarrow{^{đpnc}}Ba+Cl_2\)
\(Cl_2+H_2\underrightarrow{^{as}}2HCl\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2FeCl_2+3Cl_2\rightarrow2FeCl_3\)
\(3Ba\left(OH\right)_2+2FeCl_3\rightarrow3BaCl_2+2Fe\left(OH\right)_3\)
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
4.
\(C_2H_2+Cl_2\rightarrow2C+2HCl\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+2KOH\rightarrow Cu\left(OH\right)_2+2KCl\)
\(2KCl+2H_2O\underrightarrow{^{đpmn}}2KOH+H_2+Cl_2\)
\(3Cl_2+6KOH\rightarrow5KCl+KClO_3+3H_2O\)
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
5.
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaCl\)
\(NaCl+H_2SO_4\rightarrow NaHSO_4+HCl\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+AgNO_3\rightarrow Cu\left(NO_3\right)_2+2AgCl\)
6.
\(NaCl+H_2SO_4\rightarrow NaHSO_4+HCl\)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+H_2O\)
\(6KOH+3Cl_2\rightarrow5KCl+KClO_3+3H_2O\)
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
\(2KCl\underrightarrow{^{đpnc}}2K+Cl_2\)
\(Cl_2+Ca\left(OH\right)_2\rightarrow CaOCl_2+H_2O\)
1. MnO2 +4HCl→ Cl2+MnCl2+4H2O
Cl2+2H2→ 2HCl
HCl+Na2O→ NaCl+H2O
2NaCl → Cl2+2Na
2Cl2+2H2O+CO2→ H2SO4 +4HCl
H2SO4+BaCl2→ 2HCl+BaSO4
2. 2KMnO4 +16HCl→ 5Cl2+8H2O+2KCl+2MnCl2
2Cl2+6KOH→ KClO3 +5KCl+3H2O
KClO3+6HCl→ 3Cl2+KCl+3H2O
3Cl2+2Fe→2 FeCl3
FeCl3+3KOH→ 3KCl +Fe(OH)3
2KCl+2H2O→ KOH+Cl2+2H2O
3. BaCl2 → Cl2+Ba
Cl2+2H2→ 2HCl
2HCl+Fe→ FeCl2+H2
2FeCl2+Cl2→ 2FeCl3
2FeCl3+3Ba(OH)2→ 3BaCl2+2Fe(OH)3
BaCl2+H2SO4→ 2HCl+BaSO4
Mỏi tay rồi :((
Bài 1: Hoàn thành phản ứnga) MnO2 - Cl2 - HCL - Cl2 - Clorua vôib) KMnO4 - Cl2 - KCl - Cl2 - HCl - FeCl2 - FeCl3 - Fe(OH)3c) HCl - Cl2 - NaCl - HCl - CuCl2 - AgClBài 2: Hoà tan 15,3g oxit của kim loại M hóa trị II vào một lượng dung dịch HCl 18,25% thu được 20,8g muối. Xác định tên và khối lượng dung dịch HCl đã dùngBài 3: Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dung dịch NaOH 4M (ở nhiệt độ thường)a) Viết phương trình hóa học của các phản ứng xảy rab) Xá...
Đọc tiếp
Bài 1: Hoàn thành phản ứng
a) MnO2 -> Cl2 -> HCL -> Cl2 -> Clorua vôi
b) KMnO4 -> Cl2 -> KCl -> Cl2 -> HCl -> FeCl2 -> FeCl3 -> Fe(OH)3
c) HCl -> Cl2 -> NaCl -> HCl -> CuCl2 -> AgCl
Bài 2: Hoà tan 15,3g oxit của kim loại M hóa trị II vào một lượng dung dịch HCl 18,25% thu được 20,8g muối. Xác định tên và khối lượng dung dịch HCl đã dùng
Bài 3: Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dung dịch NaOH 4M (ở nhiệt độ thường)
a) Viết phương trình hóa học của các phản ứng xảy ra
b) Xác định nồng độ mol của những chất có trong dung dịch sau phản ứng (thể tích dd thay đổi không đáng kể)
bài 1
câu a:
Mn02 + 4HCl --> MnCl2 + Cl2 + 2H20
Cl2 + H2 -->t° ánh sáng 2HCl
4HCl + Mn02 --> MnCl2 + Cl2 + 2H20
Cl2 + 2Na -->t° 2NaCl
2NaCl -->điện phân nóng chảy 2Na + Cl2
câu b/
2KMnO4 + 16HCl (đ) -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O (Đ.C Cl2)
Cl2 + KOH -> KCl + KClO3 + H2O
2KClO3 -> 2KCl + 3O2 (đ/c khí O2 lớp 8)
2KCl -> 2K + Cl2
Cl2 + H2O ->HCl + HClO
2HCl + Fe -> FeCl2 + H2
2FeCl2 + Cl2 -> 2FeCl3
FeCl3 + NaOH -> Fe(OH)3 + NaCl
câu c/
HCl ---> Cl2 ---> FeCl3 ---> NaCl ---> HCl ---> CuCl2 ---> AgCl
2HCl→Cl2+H2
3Cl2+2Fe→2FeCl3
3NaOH+FeCl3→3NaCl+Fe(OH)3
H2SO4+NaCl→HCl+NaHSO4
CuO+2HCl→2H2O+CuCl2
2AgNO3+CuCl2→2AgCl+Cu(NO3)2
Đúng 0
Bình luận (0)
Bài 2:
CTHH: MO
\(n_{MO}=\dfrac{15,3}{M_M+16}\left(mol\right)\)
PTHH: MO + 2HCl --> MCl2 + H2O
=> \(n_{MCl_2}=\dfrac{15,3}{M_M+16}\left(mol\right)\)
=> \(\dfrac{15,3}{M_M+16}\left(M_M+71\right)=20,8\)
=> MM = 137 (g/mol)
=> M là Ba (Bari)
\(n_{BaO}=\dfrac{15,3}{153}=0,1\left(mol\right)\)
PTHH: BaO + 2HCl --> BaCl2 + H2O
0,1-->0,2
=> mHCl = 0,2.36,5 = 7,3 (g)
=> \(m_{ddHCl}=\dfrac{7,3.100}{18,25}=40\left(g\right)\)
Đúng 0
Bình luận (0)
Bài 3:
a)
MnO2 + 4HCl --to--> MnCl2 + Cl2 + 2H2O
2NaOH + Cl2 --> NaCl + NaClO + H2O
b)
nNaOH = 0,5.4 = 2 (mol)
\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
PTHH: MnO2 + 4HCl --to--> MnCl2 + Cl2 + 2H2O
0,8--------------------------->0,8
2NaOH + Cl2 --> NaCl + NaClO + H2O
1,6<--0,8----->0,8----->0,8
=> \(\left\{{}\begin{matrix}n_{NaOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{NaCl}=0,8\left(mol\right)\\n_{NaClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(NaOHdư\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(NaCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(NaClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)
Đúng 0
Bình luận (0)