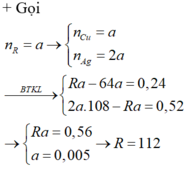Nung nóng kim loại M trong O2 dư thì thấy khối lượng chất rắn thu được tăng 25% so với ban đầu. Tìm kim loại R

Những câu hỏi liên quan
Cho m gam bột kim loại R hóa trị 2 vào dung dịch CuSO4 dư. Sau phản ứng hoàn toàn, khối lượng chất rắn thu được giảm 0,24 gam so với khối lượng chất rắn ban đầu. Cũng cho m gam bột kim loại trên vào dung dịch AgNO3 dư, đến khi phản ứng hoàn toàn, khối lượng chất rắn thu được tăng 0,52 gam so với khối lượng chất rắn ban đầu. Kim loại R là A. Sn B. Cd C. Zn D. Pb
Đọc tiếp
Cho m gam bột kim loại R hóa trị 2 vào dung dịch CuSO4 dư. Sau phản ứng hoàn toàn, khối lượng chất rắn thu được giảm 0,24 gam so với khối lượng chất rắn ban đầu. Cũng cho m gam bột kim loại trên vào dung dịch AgNO3 dư, đến khi phản ứng hoàn toàn, khối lượng chất rắn thu được tăng 0,52 gam so với khối lượng chất rắn ban đầu. Kim loại R là
A. Sn
B. Cd
C. Zn
D. Pb
Cho 13 gam kim loại R tan hết trong dung dịch HCl dư. Lượng khí hiđro thoát ra được dẫn qua bột đồng (II) oxit dư nung nóng, sau khi phản ứng hoàn toàn thấy khối lượng chất rắn giảm 3,2 gam so với khối lượng đồng (II) oxit ban đầu. Viết phương trình hóa học của các phản ứng xảy ra, xác định R?
CuO+H2to→Cu+H2O
Theo PT: nCuO=nCu(1)
Ta có mrắngiảm=mCuO−mCu=3,2(g)
→80nCuO−64nCu=3,2(2)
Từ (1)(2)→nCuO=nCu=\(\dfrac{3,2}{80-64}\)=0,2(mol)(1)(2)
→nCuO=nCu=3,280−64=0,2(mol)
Theo PT: nH2=nCu=0,2(mol)
Đặt hóa trị R là n(n>0)
2R+2nHCl→2RCln+nH2
Theo PT: nR.n=2nH2
→\(\dfrac{13n}{MR}\)=0,4
→MR=32,5n
Với n=2→MR=65(g/mol)
→R là kẽm (Zn)
Đúng 3
Bình luận (0)
Hòa tan M gam kim loại R ( có một hóa trị duy nhất ) vào dung dịch H2SO4 loãng dư sau phản ứng thấy khối lượng dung dịch tăng 1,2 gam so với dung dịch axit ban đầu nung lượng kim loại R nói trên ngoài không khí đến khối lượng không đổi thu được 2,55 gam chất rắn . Thấy có V lít không khí ( đktc ) tham gia phản ứng.
a ) Xác định kim loại R và tính m
b ) tính V ( biết oxi chiếm khoảng 20% thể tích không khí )
Đọc tiếp
Hòa tan M gam kim loại R ( có một hóa trị duy nhất ) vào dung dịch H2SO4 loãng dư sau phản ứng thấy khối lượng dung dịch tăng 1,2 gam so với dung dịch axit ban đầu nung lượng kim loại R nói trên ngoài không khí đến khối lượng không đổi thu được 2,55 gam chất rắn . Thấy có V lít không khí ( đktc ) tham gia phản ứng. a ) Xác định kim loại R và tính m b ) tính V ( biết oxi chiếm khoảng 20% thể tích không khí )
a)
Gọi số mol R là a (mol)
PTHH: 2R + nH2SO4 --> R2(SO4)n + nH2
a------------------------->0,5an
mtăng = mR - mH2 = a.MR - 2.0,5an = a.MR - an = 1,2 (1)
PTHH: 4R + nO2 --to--> 2R2On
a--------------->0,5a
=> \(0,5a\left(2.M_R+16n\right)=2,55\)
=> a.MR + 8an = 2,55 (2)
(1)(2) => a.MR = 1,35; an = 0,15
=> \(M_R=9n\left(g/mol\right)\)
Xét n = 3 thỏa mãn => MR = 27 (g/mol)
=> R là Al
a = 0,05 (mol)
m = 1,35 (g)
b)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,05->0,0375
=> VO2 = 0,0375.22,4 = 0,84 (l)
=> Vkk = 0,84 : 20% = 4,2 (l)
Đúng 2
Bình luận (2)
Nung nóng 3,72g hỗn hợp bột các kim loại Zn và Fe trong bột S dư. Chất rắn thu được sau phản ứng được hòa tan hoàn toàn bằng dung dịch H2SO4 loãng, nhận thấy có 1,344 lít khí (đktc) thoát ra. Xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Đặt nZn = x mol; nFe = y mol.
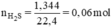
Ta có hệ phương trình: 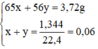
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g
Đúng 1
Bình luận (0)
Để xác định hàm lượng C trong một mẫu họp kim Fe-C, người ta đem nung m gam hợp kim này trong không khí. Sau phản ứng hoàn toàn, chất rắn thu được có khối lượng tăng 28,89% so với lượng chất rắn ban đầu. Công thức hoá học của loại hợp kim trên là A. FeC B.
FeC
2
C.
FeC
3
D.
Fe
3
C
Đọc tiếp
Để xác định hàm lượng C trong một mẫu họp kim Fe-C, người ta đem nung m gam hợp kim này trong không khí. Sau phản ứng hoàn toàn, chất rắn thu được có khối lượng tăng 28,89% so với lượng chất rắn ban đầu. Công thức hoá học của loại hợp kim trên là
A. FeC
B. FeC 2
C. FeC 3
D. Fe 3 C
Đáp án D
Đặt số mol Fe và C trong hợp kim lần lượt là x và y.
Vậy m = 56x + 12y
Phản ứng xảy ra khi nung hợp kim này trong không khí:

Đúng 0
Bình luận (0)
Cho một thanh hợp kim nặng 8,8 gam chứa các kim loại Ag, Fe, Mg hòa tan trong 750 ml CuSO4 0,1M. Sau một thời gian, thu được thanh hợp kim X và dung dịch Y. Rửa sạch và sấy khô thanh hợp kim X và cân thấy khối lượng tăng thêm so với thanh hợp kim ban đầu là 1,16 gam. Nhúng thanh X vào dung dịch H2SO4 đặc nóng dư thì thu được 2,576 lít khí SO2 (đktc). Cho 800 ml dung dịch NaOH 0,2M vào dung dịch Y, lọc lấy kết tủa rửa sạch, nung trong không khí đến khối lượng không đổi thu được 5 gam chất rắn. Ph...
Đọc tiếp
Cho một thanh hợp kim nặng 8,8 gam chứa các kim loại Ag, Fe, Mg hòa tan trong 750 ml CuSO4 0,1M. Sau một thời gian, thu được thanh hợp kim X và dung dịch Y. Rửa sạch và sấy khô thanh hợp kim X và cân thấy khối lượng tăng thêm so với thanh hợp kim ban đầu là 1,16 gam. Nhúng thanh X vào dung dịch H2SO4 đặc nóng dư thì thu được 2,576 lít khí SO2 (đktc). Cho 800 ml dung dịch NaOH 0,2M vào dung dịch Y, lọc lấy kết tủa rửa sạch, nung trong không khí đến khối lượng không đổi thu được 5 gam chất rắn. Phần trăm khối lượng của Ag trong hợp kim là:
A. 61,36%
B. 36,82%
C. 49,09%
C. 49,09%
Đáp án A
Nếu Mg còn dư trong phản ứng
=> mthanh hợp kim tăng = (64-24).0,075=3g > 1,16 g
=> Chứng tỏ Mg phản ứng hết.
Đặt số mol Mg và Fe phản ứng lần lượt là x, y.
=> mthanh hợp kim tăng =x(64-24)+y(64-56)=1,16g
Có ![]()
=> NaOH phản ứng với Y còn dư => 5 gam chất rắn gồm MgO, Fe2O3, có thể có CuO
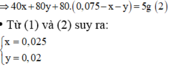
Đặt số mol Al và Fe còn dư lần lượt là a, b
=> mthanh hợp kim = 108a+24.0,025+56.(0,02+b)=8,8g
→ BTe a + 3 b + 2 . ( 0 , 025 + 0 , 02 ) = 2 . n S O 2 = 2 . 2 , 576 22 , 4 = 0 , 23 m o l

Đúng 0
Bình luận (0)
Câu 45: Cho 100 gam hỗn hợp gồm 2 kim loại Fe, Cu vào dung dịch CuSO4 dư sau phản ứng thấy khối lượng chất rắn thu được tăng thêm 4 gam so với ban đầu. Vậy phần trăm khối lượng của Cu trong hỗn hợp ban đầu là
\(PT:Fe+Cu3O_4\rightarrow FeSO_4+Cu\)
\(m\uparrow=-mFe+mCu=4\left(g\right)\)
\(nFe=\dfrac{4}{-56+64}=0,5\left(mol\right)\)
\(\Rightarrow mFe=28\left(g\right)\Rightarrow mCu=72\)
Đúng 4
Bình luận (0)
Cho 22,2 gam hh gồm 2 kim loại Al và Fe vào dd fecl2 dư sau phản ứng thấy khối lượng chất rắn thu đc tăng thêm 11,4 gam so với ban đầu . Tính % khối lượng của mỗi kim loại ban đâu
M là kim loại có duy nhất một số oxi hóa trong hợp chất. Chia m gam kim loại M thành 2 phần bằng nhau. Phần 1 cho tan vào dd HCl dư thấy khối lượng dung dịch tăng 4,8 g so vs m dd HCl ban đầu. Phần 2 tác dụng vừa đủ vs khí clo thu đc chất rắn có khối lượng tăng thêm 21,3 g so vs lượng kim loại ban đầu. Kim loại M là
https://i.imgur.com/vZ36bcE.jpg
https://i.imgur.com/o0jGrqO.jpg