Để loại khí HCl thoát ra cùng với khí C l 2 trong phản ứng M n O 2 + 4 H C l → t o M n C l 2 + C l 2 + 2 H 2 O người ta dùng
A. dung dịch NaOH
B. dung dịch NaCl bão hòa
C. H 2 S O 4 đặc
D. dung dịch nước vôi trong
Thể tích khí clo cần phản ứng với kim loại M bằng 1,5 lần lượng khí sinh ra khi cho cùng lượng kim loại đó tác dụng hoàn toàn với dung dịch axit HCl dư trong cùng điều kiện. Khối lượng muối clorua sinh ra trong phản ứng với clo gấp 1,2886 lần lượng sinh ra trong phản ứng với axit HCl. Xác định kim loại M
Phương trình hóa học của phản ứng:
M + n/2HCl → M Cl n
M + mHCl → M Cl m + m/2 H 2
Theo đề bài, ta có:
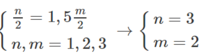
và M + 106,5 = 1,2886 (M+71)
Giải ra, ta có M = 52 (Cr)
Cho m(g) kim loại nhôm vào ống nghiệm, nhỏ từ từ dung dịch axit HCl cho đến khi nhôm tan hết thấy có 6,72 (l) khí thoát ra (đktc).
a. Viết phương trình phản ứng xảy ra
b. Tính số mol khí thoát ra
c. Tính m (g)
nH2 = 6,72/22,4 = 0,3 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
Mol: 0,2 <--- 0,6 <--- 0,2 <--- 0,3
mAl = 0,2 . 27 = 5,4 (g)
Cho 7,2 g kim loại Mg tác dụng với dung dịch HCl tạo thành muối MgCl2 và giải phóng khí H2
a) Viết phương trình phản ứng xảy ra
b) Tính thể tích khí thoát ra o đktc
a) PTHH: Mg + 2HCl ===> MgCl2 + H2\(\uparrow\)
b) nMg = 7,2 / 24 = 0,3 mol
=> nH2 = nMg = 0,3 mol
=> VH2(đktc) = 0,3 x 22,4 = 6,72 lít
a) PTHH: Mg+ 2HCl -> MgCl2 + H2
b) Thể tích khí thoát ra (đktc):
Ta có: nMg= \(\frac{7,2}{24}=0,3\left(mol\right)\)
=> \(n_{H_2}\)= nMg= 0,3 (mol)
=> \(V_{H_2\left(đktc\right)}\)= \(n_{H_2}.22,4=0,3.22,4=6,72\left(l\right)\)
Cho 20,16 lít khí CO phản ứng với một lượng oxit MxOy nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được 25,2 gam kim loại M và hỗn hợp khí X. Cho toàn bộ lượng hỗn hợp khí X qua bình chứa dung dịch Ca(OH)2 dư tạo ra m gam kết tủa và có 6,72 lít khí thoát ra. Hòa tan hoàn toàn lượng kim loại trên trong dung dịch HCl dư, thấy thoát ra 10,08 lít khí H2. Xác định công thức oxit và tính m. Biết thể tích các khí đo ở điều kiện tiêu chuẩn.
Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.

Cho cùng một lượng các kim loại Al, Zn, Mg lần lượt tác dụng hết với dung dịch H 2 SO 4 loãng, sau phản ứng thu được muối sunfat (tạo bởi kim loại kết hợp với nhóm SO 4 ) và khí H 2 . Vậy thể tích khí H 2 thoát ra từ kim loại nào lớn nhất?
có ai giúp mik ik
Gọi mMg = mZn = mFe = a(g)
\(n_{Mg}=\dfrac{a}{24}\left(mol\right),n_{Al}=\dfrac{a}{27}\left(mol\right)\\ n_{Zn}=\dfrac{a}{65}\left(mol\right),n_{Fe}=\dfrac{a}{56}\left(mol\right)\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(\dfrac{a}{24}\) --> \(\dfrac{a}{24}\left(mol\right)\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{a}{27}\) --> \(\dfrac{a}{16}\left(mol\right)\) (2)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(\dfrac{a}{65}\) --> \(\dfrac{a}{65}\left(mol\right)\) (3)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\dfrac{a}{56}\) --> \(\dfrac{a}{56}\left(mol\right)\) (4)
Từ (1),(2),(3),(4) có: \(\dfrac{a}{16}>\dfrac{a}{24}>\dfrac{a}{56}>\dfrac{a}{65}\)
Vậy \(V_{H_2}\) thoát ra từ kim loại \(Al\) là lớn nhất
a) $Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH :
$n_{H_2} = n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$V_{H_2} = 0,2.22,4 = 4,48(lít)$
b) $n_{HCl} = 2n_{Fe} = 0,4(mol)$
$m_{HCl} = 0,4.36,5 = 14,6(gam)$
c) $2H_2 + O_2 \xrightarrow{t^o}2H_2O$
Theo PTHH :
$V_{O_2} = \dfrac{1}{2}V_{H_2} = 2,24(lít)$
$n_{H_2O} = n_{H_2} = 0,2(mol)$
$m_{H_2O} = 0,2.18 = 9(gam)$
Cho 2,16 gam kim loại M hóa trị II phản ứng HNO3 dư tạo 0,224(l) N2(dktc) và 14,12 gam muối
a) Tìm M
b) Lấy 3 muối cùng 1 axit của M là A;B;C tác dụng với HCl thì thầy cùng 1 lượng HCl phản ứng cho một chất khí với tỉ lệ 2 : 4 : 1. Tìm A;B;C
a, Theo gt ta có: $n_{N_2}=0,01(mol)$
$\Rightarrow n_{e}=0,1(mol)\Rightarrow m_{muoi}=2,16+6,2=8,36< 14,12(g)$
Do đó phản ứng có tạo $NH_4NO_3$
Gọi số mol $NH_4NO_3$ là x(mol)
Ta có: $2,16+80x+62.(0,1+8x)=14,12\Rightarrow x=0,01(mol)$
Do đó $M_{M}=24$. Do đó M là Mg
b, Để thỏa mãn thì ta nghĩ đến việc muối đó có thể là gốc muối cacbonat hay là gốc muối sunfit.
A;B;C có thể là $MgCO_3;Mg(HCO_3)_2;Mg(OH)_2.MgCO_3$ thỏa mãn tỉ lệ
a) Gọi \(n_{NH_4NO_3} = a(mol) ; n_{N_2} = 0,01(mol)\)
\(\Rightarrow n_{NO_3^-\ trong\ muối} = n_e = 8n_{NH_4NO_3} = 10n_{N_2} = 8a + 0,1\)
Ta có: 2,16 + (8a + 0,1).62 + 80a = 14,12
Suy ra: a = 0,01
Suy ra:
\(n_M = \dfrac{n_e}{2} = \dfrac{0,01.8 + 0,1}{2} = 0,09(mol)\\ \Rightarrow M = \dfrac{2,16}{0,09} = 24(Magie)\)
b)
Muối A,B,C đều tạo bởi một axit và đều tạo cùng một khí khi tác dụng với HCl, do đó :
\(A\ :\ MgCO_3\\ B\ :\ Mg(HCO_3)_2\\ C\ :\ (MgOH)_2CO_3\)
\(MgCO_3 + 2HCl \to MgCl_2 + CO_2 +H_2O\\ Mg(HCO_3)_2 + 2HCl \to MgCl_2 +2CO_2 + 2H_2O\\ (MgOH)_2CO_3 + 4HCl \to 2MgCl_2 + CO_2 + 2H_2O\)
Hỗn hợp X gồm Al và Fe2O3, lấy 85,6 gam X đem nung nóng để thực hiện phản ứng nhiệt nhôm (giả sử chỉ xảy ra phản ứng khử oxit kim loại thành kim loại), sau một thời gian thu được chất rắn Y. Chia Y làm 2 phần bằng nhau:
- Phần 1: hòa tan dung dịch NaOH dư thấy thoát ra 3,36 lít khí (đktc) và còn lại m gam chất không tan.
- phần 2: hòa tan hết trong dung dịch HCl thấy thoát ra 10,08 lít khí (đktc)
Giá trị m là:
A. 16,8
B. 24,8
C.32,1
D. Đáp án khác
Cho 5,6g kim loại sắt tác dụng với dd hcl dư
a, viết phương trình phản ứng hóa học xảy ra
b, tính thể tích khí h2 thoát ra ( ở đktc )
c, tính khối lượng a xit hcl đã phản ứng
a) PTHH : \(Fe+2HCl-->FeCl_2+H_2\)
b) \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PTHH : nH2 = nFe = 0,1 (mol)
=> VH2 = \(0,1.22,4=2,24\left(l\right)\)
c) Theo PTHH : \(n_{HCl\left(pu\right)}=2n_{Fe}=0,2\left(mol\right)\)
=> mHCl = 0,2.36,5 = 7,3 (g)