Cho 20,55g kim loại hóa trị 2 vào nước thu được 3,36 lit khí ở đktc.
Xã định kim lợi đã dùng
Cho 3,36 lit khí oxi (ở đktc) phản ứng hoàn toàn với 1 kim loại hóa trị III thu được 10,2g oxit. Xác định tên kim loại.
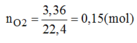
Gọi A là kí hiệu của kim loại có hóa trị III, M A là nguyên tử khối của A.
Ta có PTHH:

Theo PTHH trên ta có:
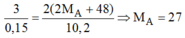
Vậy A là nhôm.
Cho 20,55g kim loại M hóa trị II tác dụng hết với nước thu được 3,36 lit khí ở đktc. M là kim loại nào?
(Mn giúp e vs ạ)
PTHH: M + 2H2O \(\rightarrow\) M(OH)2 + H2\(\uparrow\)
n\(H_2\) = \(\frac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: nM = n\(H_2\) = 0,15 (mol)
=> MM = \(\frac{m_M}{n_M}=\frac{20,55}{0,15}=137\left(\frac{g}{mol}\right)\)(Ba)
Vậy M là Bari (Ba)
Kim loại + nước -> bazơ + H2
=> khí đó là H2
nH2=3,36/22,4=0,15 (mol)
PTHH
M + 2H2O -> M(OH)2 + H2
1 mol_________________ 1mol
x mol_______________ 0,15 mol
nM= x =0,15.1/1= 0,15 (mol)
PTKM= m/n= 20,55/0,15=137đvC
137 đvC là Bari
nH2= 3.36/22.4=0.15 mol
M + 2H2O --> M(OH)2 + H2
0.15__________________0.15
M M = 20.55/0.15=137 (Ba)
Vậy: M là Bari
nH2 = 3.36/22.4 = 0.15 (mol)
M + H2SO4 => MSO4 + H2
0.15________________0.15
MM = 3.6/0.15 = 24
M là : Mg
Bảo toàn electron :
\(2n_M = 2n_{H_2}\\ \Rightarrow n_M = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ \Rightarrow M = \dfrac{3,6}{0,15} = 24(Magie)\)
Vậy Kim loại M là Magie
Hòa tan hoàn toàn 6 gam một kim loại M hóa trị II vào dung dịch HCl, sau phản ứng thu được 3,36 lit khí H 2 (đktc). Kim loại M là:
A. Zn (65)
B. Mg (24)
C. Fe (56)
D. Ca (40)
Chọn D
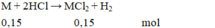
M M = 6 : 0 , 15 = 40 .
Vậy kim loại M là Ca.
hòa tan hoàn toàn 9,75g kim loại M chưa rõ hóa trị trong dd H2SO4 loãng dư thu được 3,36 lít khí H2 ( đktc).Xác định tên M và m HCl đã dùng
cho 19,2 gam kim loại hóa trị II tác dụng với 3,36 lít khí Oxi ở đktc , tạo ra oxit bazơ . tìm kim loại đã phả ứng và khối lượng oxit thu được
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH : \(2X+O_2\underrightarrow{t^o}2XO\)
0,3 0,15 /mol
Ta có : \(0,3=\dfrac{19,2}{X}\Rightarrow X=64\) => X là Cu
\(m_{CuO}=80.0,3=24\left(g\right)\)
Gọi R là kim loại cần tìm.
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(2R+O_2\underrightarrow{t^o}2RO\)
\(\dfrac{19,2}{R}\) 0,15
\(\Rightarrow\dfrac{19,2}{R}=0,15\cdot2\Rightarrow R=64\Rightarrow Cu\)
Khối lượng oxit: \(m_{CuO}=0,3\cdot80=24g\)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)
\\
pthh:2A+O_2\underrightarrow{t^o}2AO\)
0,3 0,15
=> \(M_A=\dfrac{19,2}{0,3}=64\left(\dfrac{g}{mol}\right)\)
=> ntu là Cu
hòa tan hết m(g) cacbonat của kim loại R hóa trị 2 vào 100(g) dd HCl dư . Sau phản ứng thu được 3,36(l) khí ở (đktc) và 110,8(g) dd A . Xác định kim loại R và viết công thức hóa học
Gọi CTHH của muối là RCO3
nCO2 = \(\frac{3,36}{22,4}\) = 0,15 (mol)
RCO3 + HCl \(\rightarrow\) RCl2 + H2O + CO2
0,15 <------------------------------- 0,15 (mol)
Áp dụng ĐLBTKL ta có:
m + 100 = 110,8 + 0,15 . 44
\(\Rightarrow\) m = 17,4 (g)
Mmuối = \(\frac{17,4}{0,15}\) = 116 (g/mol)
\(\Rightarrow\) R + 60 = 116
\(\Rightarrow\) R = 56 (g/mol)
\(\Rightarrow\) R = 56 đvC (Fe: sắt)
CTHH của muối là FeCO3
I Bài 6: Cho 8,4 gam kim loại R hóa trị II tác dụng vừa đủ với dung dịch acid HCI 15% thu được 3,36 lít khí hidro ( ở đktc). a. Xác định kim loại R. b. Tính khối lượng dung dịch acid cần dùng cho phản ứng.
a, \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: R + 2HCl → RCl2 + H2
Mol: 0,15 0,3 0,15
\(M_R=\dfrac{8,4}{0,15}=56\left(g/mol\right)\)
⇒ R là sắt (Fe)
b, \(m_{ddHCl}=\dfrac{0,3.36,5.100}{15}=73\left(g\right)\)
Cho 7,8g kim loại A (hóa trị I) tác dụng hết với 200ml H2O thu được baozo và 2,24 lit H2 thoát ra ở đktc . a. Xác định tên kim loại A ? b. Tíh khối lượng m (g) muối thu được c. Tính nồng độ mol (CM) của dung dịch H2SO4 đã dùng ?