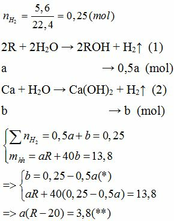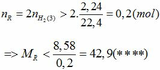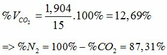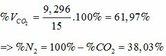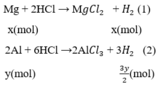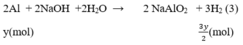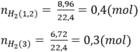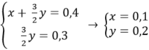1.Cho 6,8 g hỗn hợp các kim loại Mg và Fe tác dụng với dung dịch H2 SO4 1,5 m khi phản ứng kết thúc thu được 3.36 lít khí H2(đktc).Tính khối lượng muối thu được và thể tích dung dịch H2 SO4 cần dùng?
2.Cho 3,14 g hỗn hợp các kim loại Zn và Al tác dụng với 200 ml dung dịch H2 SO4 khi phản ứng kết thúc thu được 15,68 lít khí H2(đktc).Tính khối lượng muối thu được và nồng độ mol H2 SO4 cần dùng?
3.Cho 12,6 g hỗn hợp các kim loại Mg và Al tác dụng với dung dịch H2 SO4 đặc dư nóng khi phản ứng kết thúc thu được 13,44 lít khí SO2(đktc).
a.Tính khối lượng muối thu được.
b.Cho hỗn hợp trên tác dụng với H2 SO4 đặc nguội thu được V lít khí SO2 ở đktc .Tính V.
4.Cho 36g hỗn hợp X chứa Fe2o3 và CuO tác dụng vừa đủ với 500 ml dung dịch H2 SO4 thu được 80 gam hỗn hợp muối.
a.Tính phần trăm khối lượng từng chất trong hỗn hợp X .
b.Tính nồng độ mol dung dịch H2 SO4 cần dùng.