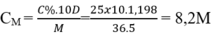Dung dịch HCL 25% (D=1,1198 g/ml). Tính Cm

Những câu hỏi liên quan
Câu 15: tính C% của 50ml dung dịch HCl 0,5M (biết d=1,05 g/ml)
Câu 16: Tính CM của 200g dung dịch H2SO4 9,8% (biết d=1,6 g/ml)
Câu 17: tính C% của dung dịch H2SO4 nếu bt khi cho 1 lượng dung dịch này tác dụng với lượng dư hỗn hợp Na, Mg thì lượng H2 thoát ra bằng 4,5% khối lượng dd axit đã dùng
Giúp mình với nha mn
Tính nồng độ mol của dung dịch HCl, biết dung dịch HCl 25% có khối lượng riêng bằng 1,198 g/ml.
A. 8M
B. 8,2M
C. 7,9M
D. 6,5M
Hoà tan hoàn toàn 14 gam kim loại A bằng dung dịch HCl 18,25% (D = 1,2 g/ml) (dư 10%), thu được dung dịch muối và 5,6 lít khí hiđro (đktc).
a/ Xác định kim loại A.
b/ Tính khối lượng dung dịch HCl 18,25% đã dùng.
c/ Tính CM của dung dịch HCl và dung dịch muối sau phản ứng.
Hoà tan hoàn toàn 14 gam kim loại A bằng dung dịch HCl 18,25% (D = 1,2 g/ml) (dư 10%), thu được dung dịch muối và 5,6 lít khí hiđro (đktc).
a/ Xác định kim loại A.
b/ Tính khối lượng dung dịch HCl 18,25% đã dùng.
c/ Tính CM của dung dịch HCl và dung dịch muối sau phản ứng.
a) \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2A + 2nHCl --> 2AlCln + nH2
\(\dfrac{0,5}{n}\)<-------------------0,25
=> \(M_A=\dfrac{14}{\dfrac{0,5}{n}}=28n\left(g/mol\right)\)
Xét n = 2 thỏa mãn => MA = 56 (g/mol)
=> A là Fe
b)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,25<-0,5<----0,25<---0,25
=> nHCl(thực tế) = \(\dfrac{0,5.110}{100}=0,55\left(mol\right)\)
=> mHCl(thực tế) = 0,55.36,5 = 20,075 (g)
=> \(m_{dd.HCl}=\dfrac{20,075.100}{18,25}=110\left(g\right)\)
c) Vdd = \(\dfrac{110}{1,2}=\dfrac{275}{3}\left(ml\right)=\dfrac{11}{120}\left(l\right)\)
\(C_{M\left(dd.HCl.bđ\right)}=\dfrac{0,55}{\dfrac{11}{120}}=6M\)
- dd sau pư chứa HCl dư và FeCl2
\(C_{M\left(FeCl_2\right)}=\dfrac{0,25}{\dfrac{11}{120}}=\dfrac{30}{11}M\)
\(C_{M\left(HCl.dư\right)}=\dfrac{0,55-0,5}{\dfrac{11}{120}}=\dfrac{6}{11}M\)
Đúng 2
Bình luận (0)
từ các dung dịch hcl 36 % (d = 1,18g/ml ) , H2So4 96% ( d = 1,84g/mL)
. pha 100mL dung dịch HCL 0,1M
. pha 100ml dung dịch h2so4 0.05M
b. Từ tinh thể NaOH 96% hãy tính pha 100ml NaOH 25%
Hoà tan hoàn toàn 16,25 gam kim loại A hoá trị II bằng dung dịch HCl 18,25% (D 1,2 g/ml) vừa đủ, thu được dung dịch muối và 5,6 lít khí hiđro (đktc).a/ Xác định kim loại A. b/ Tính khối lượng dung dịch HCl 18,25% đã dùng. c/ Tính CM của dung dịch HCl và dung dịch muối sau phản ứng.
Đọc tiếp
Hoà tan hoàn toàn 16,25 gam kim loại A hoá trị II bằng dung dịch HCl 18,25% (D = 1,2 g/ml) vừa đủ, thu được dung dịch muối và 5,6 lít khí hiđro (đktc).
a/ Xác định kim loại A.
b/ Tính khối lượng dung dịch HCl 18,25% đã dùng.
c/ Tính CM của dung dịch HCl và dung dịch muối sau phản ứng.
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
a.
\(A+2HCl\rightarrow ACl_2+H_2\)
0,25 0,5 0,25 0,25
=> \(M_A=\dfrac{16,25}{0,25}=65\)
Vậy kim loại A là Zn.
b.
\(m_{dd.HCl}=\dfrac{0,5.36,5.100}{18,25}=100\left(g\right)\)
c.
\(V_{dd.HCl}=\dfrac{m_{dd.HCl}}{D_{dd.HCl}}=\dfrac{100}{1,2}=83\left(ml\right)\)
Đổi: 83 ml = 0,083 (l)
\(CM_{dd.HCl}=\dfrac{0,5}{0,083}=6M\)
(Nếu V không đổi thì mới tính được CM dd muối sau pứ, còn đề không nói thì mình cũng không biết nữa).
Đúng 0
Bình luận (0)
MỌI NGƯỜI GIÚP EM VỚI Ạ. MAI EM CẦN RỒI Ạ.
Câu 1: Dung dịch AgNo3 1M (D1,2g/ml). TÍnh C% của dung dịch.
Câu 2: Hãy biểu diễn dung dịch H2So4 98% (D 1,84g/ml) để điều chế được 4 lít dung dịch h2so4 4M
Câu 3: Thêm H20 vào 150 g dung dịch HCl 2,65% tạo thành 2l dung dịch. Tính Cm của dung dịch thu được?
Câu 4: Dung dịch ZnCl2 25% ( D1,238g/ml) có D?
Câu 5: Dung dịch NaOH 0,2M (D 1,08g/ml) có C%?
Câu 6: Cm dung dịch h2so4 chứa 2% h2o (D1,84g/ml) là bao nhiêu?
Câu 7: Cần lấy bao nhiêu lít dung...
Đọc tiếp
MỌI NGƯỜI GIÚP EM VỚI Ạ. MAI EM CẦN RỒI Ạ.
Câu 1: Dung dịch AgNo3 1M (D=1,2g/ml). TÍnh C% của dung dịch.
Câu 2: Hãy biểu diễn dung dịch H2So4 98% (D= 1,84g/ml) để điều chế được 4 lít dung dịch h2so4 4M
Câu 3: Thêm H20 vào 150 g dung dịch HCl 2,65% tạo thành 2l dung dịch. Tính Cm của dung dịch thu được?
Câu 4: Dung dịch ZnCl2 25% ( D=1,238g/ml) có D=?
Câu 5: Dung dịch NaOH 0,2M (D= 1,08g/ml) có C%=?
Câu 6: Cm dung dịch h2so4 chứa 2% h2o (D=1,84g/ml) là bao nhiêu?
Câu 7: Cần lấy bao nhiêu lít dung dịch HCl 36% (D= 1,19g/ml) để pha được 5 lít dung dịch HCl 0,5M
Từ công thức: \(C_M=\dfrac{10\cdot D\cdot C\%}{M}\)
\(\Rightarrow C\%=\dfrac{C_M\cdot M}{10\cdot D}\)
Áp dụng công thức này vào từng bài thì sẽ làm được 1 số bài!
Câu 1: => \(C\%_{AgNO3}=\dfrac{1\cdot170}{1,2\cdot10}=14,167\%\)
Câu .....
Đúng 0
Bình luận (0)
cho V ml dung dịch HCl 1M tác dụng hoàn toàn với 200 gam dung dịch NaOH 15% tính V
a.Tính V
b.Tính Cm các chất có trong dung dịch phản ứng biết D của NaOH bằng 0,8 g/m3
Trộn 150ml dung dịch HCl 10% có khối lượng riêng D=1,206 g/ml với 250 ml dung dịch HCl 2M thu được dung dịch A . Tính nồng độ mol của dung dịch A
\(m_{dd_{HCl\left(10\%\right)}}=150\cdot1.206=180.9\left(g\right)\)
\(n_{HCl}=\dfrac{180.9\cdot10\%}{36.5}\approx0.5\left(mol\right)\)
\(n_{HCl\left(2M\right)}=0.25\cdot2=0.5\left(mol\right)\)
\(n_{HCl}=0.5+0.5=1\left(mol\right)\)
\(V_{dd_{HCl}}=150+250=400\left(ml\right)=0.4\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{1}{0.4}=2.5\left(M\right)\)
Đúng 4
Bình luận (0)