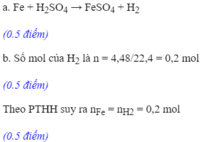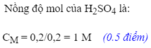17: Cho 4.05 (g) kim loại Al vào dung dịch H2SO4 (axit sulfuric) , sau phản ứng thu được 3,36 (l) khí (đktc)
a: Viết Phương Trình Phản Ứng.
b: Tính khối lượng Al đã phản ứng.
c: Tính khối lượng muối thu được, và khối lượng chất còn dư nếu có.
d: Tính khối lượng Axit H2SO4 đã phản ứng
18: Đốt Sắt trong 1 bình kín có chứa 8,4 (l) khí Oxi (đktc) , sau phản ứng thu được 34,8 (g) Oxit sắt từ
a: Tính lượng Sắt đã tham gia phản ứng
b: Tính thể tích khí Oxi đã dùng (đktc)
c: Để có 8,4 (l) khí Oxi trên ta phải phản ứng hủy bao nhiêu (g) Kali Clorat
TỔNG HỢP
19: Cho 8,4 (g) Sắt vào dung dịch có chứa 19,6 (g) Axit Sunfuric
a: Viết phương trình phản ứng
b: Tính thể tích khí H2(Hiđro) thu được (đktc)
c: Tính khối lượng muối tạo thành
20: Cho 13 (g) Kẽm vào dung dịch có chứa 10,95 (g) Axit Clohidric. Dùng toàn bộ khí Hiđro sinh ra để khử Đồng (II) Oxit
a: Viết phương trình phản ứng
b: Tính khối lượng Đồng (II) Oxit đã tham gia phản ứng
c: Tính khối lượng Đồng thu được
Giúp mình với mọi người ơi