So sánh tính bazo của: Na2O, Al2O3, MgO, K2O. Giải thích?
So sánh tính phi kim của: P, S, O, Cl. Giải thích?
So sánh tính kim loại của: Ca, K, Mg. Giải thích?
So sánh và giải thích tính phi kim của S, Cl, F, Br
So sánh tính phi kim hay kim loại hay khí hiếm của K và Mg?
So sánh bán kính nguyên tử của K và MG?
So sánh độ âm điện của K và MG?
a.So sánh tính kim loại của: Be, Ca, Ra, Mg, Sr, Ba
b. So sánh tính phi kim của: Br2, Cl2, F2, I2, At
- So sánh độ bền nhiệt của cacbonat kim loại kiềm và kiềm thổ? Giải thích?
a) So sánh tính phi kim và tính axit của các hidroxit tương ứng của các nguyên tố sau: 15P, 14Si, 7N.
b) So sánh tính kim loại và tính bazơ của các hidroxit tương ứng của các nguyên tố sau: 20Ca, 19K, 37Rb.
c) So sánh tính kim loại và tính bazơ của các hidroxit tương ứng của các nguyên tố sau: 12Mg, 19K, 13Al.
a) Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b) Vì sao cả Na2O và MgO đều là chất rắn ở nhiệt độ thường?
c) Vì sao nhiệt độ nóng chảy của MgO (2 852oC) cao hơn rất nhiều so với Na2O (1 132oC)?
a)
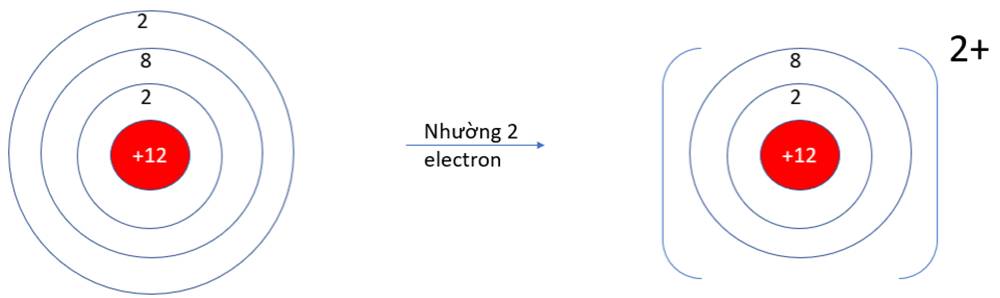
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.
So sánh tính phi kim của các nguyên tố :
a) C, Si và N
b) S, P và O
c) Cl, S và F
d) Si, S, P và Cl
a) C, Si thuộc nhóm IVA, C thuộc chu kì 2, Si thuộc chu kì 3
=> C > Si
C,N thuộc chu kì 2, C thuộc nhóm IVA, N thuộc nhóm VA
=> N > C
KL: N > C > Si
b) O, S thuộc nhóm VIA, O thuộc chu kì 2, S thuộc chu kì 3
=> O > S
S,P thuộc chu kì 3, S thuộc nhóm VIA, P thuộc nhóm VA
=> S > P
KL: O > S > P
c) F, Cl thuộc nhóm VIIA, F thuộc chu kì 2, Cl thuộc chu kì 3
=> F > Cl
S,Cl thuộc chu kì 3, S thuộc nhóm VIA, Cl thuộc nhóm VIIA
=> Cl > S
KL: F > Cl > S
d) Si, S, P, Cl thuộc chu kì 3, Si thuộc nhóm IVA, P thuộc nhóm VA, S thuộc nhóm VIA, Cl thuộc nhóm VIIA
=> Cl > S>P>Si
Câu 1.Sắp xếp các nguyên tố O (Z. = 8); Mg (Z = 12); Si (Z = 14); S (Z = 16) theo chiều giảm dần tỉnh phi kim. Giải thích. Câu 2.sắp xếp các nguyên tố Na (Z= ||) C1Z=17); A1(Z = 13); K (Z = 19) theo chiều tăng dần tính kim loại. Giải thích.