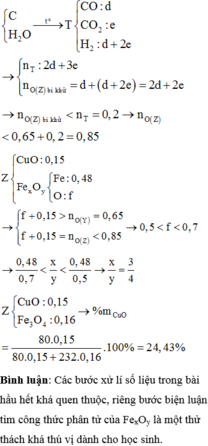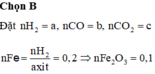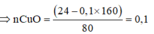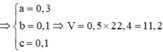Mọi người chỉ hộ nếu dùng bảo toàn e thì viết ntn :dẫn H2 qua hỗn hợp gồm CuO và FenOm.

Những câu hỏi liên quan
Một hỗn hợp A gồm CH4 , H2 , CO Thí nghiệm 1: Nếu đốt cháy 8,96lít hỗn hợp A cần dùng 7,84 lít O2 Thí nghiệm 2 : Nếu dẫn 14,8g hỗn hợp qua ống đựng CuO dư nung nóng thì có 48g CuO đã phản ứng Tính % thể tích mỗi chất trong hỗn hợp A biết các khí đo ở đktc
\(n_{CH_4} = a(mol) ; n_{H_2} = b(mol) ; n_{CO} = c(mol)\\ \Rightarrow a + b + c = \dfrac{8,96}{22,4} = 0,4(1)\\ TN1 :\\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ 2CO + O_2 \xrightarrow{t^o} 2CO_2\\ n_{O_2} = 2a + 0,5b + 0,5c = \dfrac{7,84}{22,4} = 0,35(2)\\ TN2:\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ \)
\(n_{CuO} = \dfrac{48}{80} = 0,6(mol) CuO + CO \xrightarrow{t^o} Cu + CO_2\\ \dfrac{m_{hh}}{n_{CuO}}=\dfrac{16a + 2b + 28c}{b + c} = \dfrac{14,8}{0,6}(3)\\ (1)(2)(3) \Rightarrow a = 0,1 ; b = 0,1 ; c = 0,2\\ \%V_{CH_4} = \%V_{H_2} = \dfrac{0,1}{0,4}.100\% = 25\%\\ \%V_{CO} = \dfrac{0,2}{0,4}.100\% = 50\%\)
Đúng 2
Bình luận (0)
dẫn từ từ V liít hỗn họp X (đktc) gồm CO và H2 qua ống dẫn chứa hỗn hợp gồm CuO,Fe2O3, Fe3O4 nung nóng. Phản ứng hoàn toàn thu được hỗn hợp khí và hơi có khối lượng nặng hơn hỗn hợp khí ban đầu là 0,32gam. viết PTHH xảy ra và tính V
m(tăng) = mO = 0,32 (g)
nO = 0,32/16 = 0,02 (mol)
=> nhh khí = 0,02 (mol)
=> Vhh khí = 0,02 . 22,4 = 0,448 (l)
Đúng 1
Bình luận (2)
Hỗn hợp A gồm 3 khí NH3, N2 và H2. Dẫn A vào bình có nhiệt độ cao. Sau khi NH3 phân hủy hoàn toàn thu được hỗn hợp khí B có thể tích tăng 25% so với A. Dẫn B qua ống CuO nung nóng sau đó loại nước thì chỉ còn lại một chất khí có thể tích giảm 75% so với B. Tính % thể tích H2 trong hỗn hợp A? A. 25% B. 75% C. 18,75% D. 56,25%
Đọc tiếp
Hỗn hợp A gồm 3 khí NH3, N2 và H2. Dẫn A vào bình có nhiệt độ cao. Sau khi NH3 phân hủy hoàn toàn thu được hỗn hợp khí B có thể tích tăng 25% so với A. Dẫn B qua ống CuO nung nóng sau đó loại nước thì chỉ còn lại một chất khí có thể tích giảm 75% so với B. Tính % thể tích H2 trong hỗn hợp A?
A. 25%
B. 75%
C. 18,75%
D. 56,25%
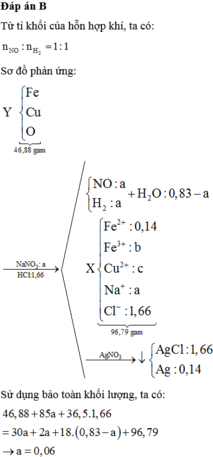
Cho hơi nước đi qua than nóng đỏ, thu được 4,48 lít (đktc) hỗn hợp khí T gồm CO, CO2 và H2. Dẫn toàn bộ T đi qua m gam hỗn hợp Z gồm FexOy và CuO nung nóng, sau khi các phản ứng xảy ra hoàn toàn, thu được 46,88 gam hỗn hợp rắn Y. Cho Y tan hoàn toàn trong dung dịch chứa NaNO3 và 1,66 mol HCl, thu được dung dịch X chỉ chứa 96,79 gam muối của kim loại và hỗn hợp hai khí gồm NO và H2, có tỉ khối so với He là 4. Cho X phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được 253,33 gam kết tủa. Phần trăm...
Đọc tiếp
Cho hơi nước đi qua than nóng đỏ, thu được 4,48 lít (đktc) hỗn hợp khí T gồm CO, CO2 và H2. Dẫn toàn bộ T đi qua m gam hỗn hợp Z gồm FexOy và CuO nung nóng, sau khi các phản ứng xảy ra hoàn toàn, thu được 46,88 gam hỗn hợp rắn Y. Cho Y tan hoàn toàn trong dung dịch chứa NaNO3 và 1,66 mol HCl, thu được dung dịch X chỉ chứa 96,79 gam muối của kim loại và hỗn hợp hai khí gồm NO và H2, có tỉ khối so với He là 4. Cho X phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được 253,33 gam kết tủa. Phần trăm khối lượng của CuO trong Z là
A. 25,77%
B. 24,43%
C. 23,81%
D. 25,60%
Để khử hoàn toàn m g hỗn hợp X gồm CuO, Fe2O3, Fe3O4 cần dùng vừa đủ 6,72 lít H2 (đktc). Nếu dùng nhôm làm chất khử thì khối lượng nhôm cần dùng để khử hoàn toàn m gam hỗn hợp X trên là
\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(H_2+O\rightarrow H_2O\)
\(0.3.....0.3\)
\(2Al+3O\rightarrow Al_2O_3\)
\(0.2......0.3\)
\(m_{Al}=0.2\cdot27=5.4\left(g\right)\)
Đúng 2
Bình luận (0)
dẫn 4,48 lít H2 (đktc) qua 20 gam hỗn hợp A nung nóng gồm CuO. Sau phản ứng xảy ra hoàn toàn thu được chất rắn X và hỗn hợp Y( gồm khí và hơi) có tỉ khối so với H2 bằng 7.
a) Viết phương trình phản ứng và tính phần trăm theo thể tích các khí trong Y.
b) Tính khối lượng MgO có trong chất rắn A.
Cho 19,5g Zn tác dụng với dd loãng có chứa 39,2g axit sunfuric.
a/ Viết PTHH của phản ứng xảy ra.
b/ Tính thể tích khí H2 thu được (đkt)
c/ Dẫn toàn bộ lượng khí thu được ở trên qua hỗn hợp bột A gồm CuO và Fe3O4 nung nóng thì thấy khối lượng hỗn hợp A giảm m gam. Xác định giá trị của m.
a/ \(Zn+H_2SO_{4_{loãng}}\rightarrow ZnSO_4+H_2\)
b/ \(n_{Zn}=0,3\left(mol\right)\\ n_{H_2SO_4}=0,4\left(mol\right)\)
Vì ta có tỉ lệ \(\dfrac{n_{Zn}}{1}< \dfrac{n_{H_2SO_4}}{1}\) nên \(H_2SO_4\) dư
\(n_{H_2}=0,3\left(mol\right)\\ V_{H_2}=0,3\times22,4=6,72\left(lít\right)\)
Đúng 0
Bình luận (0)
Dẫn 1 luồng hơi nước qua than nóng đỏ thì thu được V lít (ở đktc) hỗn hợp khí X gồm CO2, CO, H2, tỉ khối hơi của X so với H2 là 7,8. Toàn bộ V lít hỗn hợp khí X trên khử vừa đủ 24 gam hỗn hợp gồm CuO, Fe2O3 nung nóng thu được rắn Y chỉ có 2 kim loại. Cho toàn bộ Y vào dung dịch HCl dư thấy có 4,48 lít H2 bay ra (ở đktc). Giá trị của V là A. 6,72. B. 11,2. C. 8,96. D. 13,44.
Đọc tiếp
Dẫn 1 luồng hơi nước qua than nóng đỏ thì thu được V lít (ở đktc) hỗn hợp khí X gồm CO2, CO, H2, tỉ khối hơi của X so với H2 là 7,8. Toàn bộ V lít hỗn hợp khí X trên khử vừa đủ 24 gam hỗn hợp gồm CuO, Fe2O3 nung nóng thu được rắn Y chỉ có 2 kim loại. Cho toàn bộ Y vào dung dịch HCl dư thấy có 4,48 lít H2 bay ra (ở đktc). Giá trị của V là
A. 6,72.
B. 11,2.
C. 8,96.
D. 13,44.
Sử dụng định luật BTKL, bảo toàn NT để tính Câu 1 : để khử hoàn toàn 30 g hỗn hợp gồm CuO , FeO,Fe3O4,Fe2O3 cần dùng 5, 6 lít khí CO ( đkc) . Tính khối lượng chất rắn thu đc sau phản ứng ( biết CO có tính khử giống H2) .Câu 2 :dẫn luồn khí H2 dư đi qua 16g hỗn hợp hai oxide CuO và Fe2O3 nung nóng . Sau phản ứng để nguội , cân lại thấy khối lượng hỗn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxide trong hỗn hợp ban đầu .Câu 3 : Dãn luồng khí H2 dư đi qua hỗn hợp hai oxide CuO và Fe2O3 nung...
Đọc tiếp
Sử dụng định luật BTKL, bảo toàn NT để tính
Câu 1 : để khử hoàn toàn 30 g hỗn hợp gồm CuO , FeO,Fe3O4,Fe2O3 cần dùng 5, 6 lít khí CO ( đkc) . Tính khối lượng chất rắn thu đc sau phản ứng ( biết CO có tính khử giống H2) .
Câu 2 :dẫn luồn khí H2 dư đi qua 16g hỗn hợp hai oxide CuO và Fe2O3 nung nóng . Sau phản ứng để nguội , cân lại thấy khối lượng hỗn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxide trong hỗn hợp ban đầu .
Câu 3 : Dãn luồng khí H2 dư đi qua hỗn hợp hai oxide CuO và Fe2O3 nung nóng . Sau phản ứng để nguội thu , cân lại thấy khối lượng hỗn hợp giảm 28,8%. Tính phần trăm khối lượng của mỗi oxide trong hỗn hợp ban đầu .
Câu 2:
Ta có: 80nCuO + 160nFe2O3 = 16 (1)
m giảm = 16.25% = 4 (g) = mO (trong oxit)
\(\Rightarrow n_{O\left(trongoxit\right)}=\dfrac{4}{16}=0,25\left(mol\right)\)
BTNT O, có: nCuO + 3nFe2O3 = 0,25 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CuO}=0,1\left(mol\right)\\n_{Fe_2O_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,1.80}{16}.100\%=50\%\\\%m_{Fe_2O_3}=50\%\end{matrix}\right.\)
Bạn bổ sung đủ đề câu 3 nhé.
Đúng 2
Bình luận (0)
Câu 1:
Ta có: \(n_{CO}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
BTNT C, có: nCO2 = nCO = 0,25 (mol)
BTKL, có: mhh + mCO = m chất rắn + mCO2
⇒ m chất rắn = 30 + 0,25.28 - 0,25.44 = 26 (g)
Đúng 1
Bình luận (0)