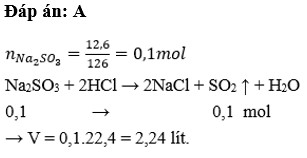Hoà tan 12,6 gam natrisunfit vào dung dịch axit clohidric dư . Thể tích khí So2 thu được ở dktc là

Những câu hỏi liên quan
Hòa tan 12,6 gam natrisunfit vào dung dịch axit clohiđric dư. Thể tích khí S O 2 thu được ở đktc là
A. 2,24 lít
B. 3,36 lit
C. 1,12 lít
D. 4,48 lít
Hòa tan hoàn toàn 12,6 gam natrisunfit trong V(ml) dung dịch HCl. Xác định khí và tính thể tích khí thu ra ở đktc?
\(n_{Na_2SO_3}=\dfrac{12,6}{126}=0,1\left(mol\right)\\ Na_2SO_3+2HCl\rightarrow2NaCl+SO_2+H_2O\)
Khí thu được: SO2 (Khí sunfuro)
\(n_{SO_2}=n_{Na_2SO_3}=0,1\left(mol\right)\\ V_{SO_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\)
Đúng 3
Bình luận (0)
\(n_{Na_2SO_3}=\dfrac{12,6}{126}=0,1mol\\ Na_2SO_3+2HCl\rightarrow2NaCl+SO_2+H_2O\\ Khí:SO_2\\ n_{SO_2}=n_{Na_2SO_3}=0,1mol\\ V_{SO_2\left(đktc\right)}=0,1.22,4=2,24l\)
Đúng 1
Bình luận (1)
Hoà tan hoàn toàn 17,6 gam hỗn hợp Fe và Cu vào dung dịch axit H2SO4 đặc nóng, dư. Sau phảnứng thu được 8,96 lit khí SO2 (đo ở đktc) và dung dịch A.a) Tính % khối lượng của mỗi kim loại trong hỗn hợp ban đầu?b) Nếu cho lượng khí SO2 thu được ở trên vào 500 ml dd NaOH 1M. Tính nồng độ mol chất trong ddthu được sau phản ứng? Biết rằng thể tích của dung dịch thay đổi không đáng kể.c) Cho 500 ml dd BaCl2 1M vào dd A. Sau phản ứng thu được m gan kết tủA. Tính m. Biết rằng lượngaxít dư so với phản ứng...
Đọc tiếp
Hoà tan hoàn toàn 17,6 gam hỗn hợp Fe và Cu vào dung dịch axit H2SO4 đặc nóng, dư. Sau phản
ứng thu được 8,96 lit khí SO2 (đo ở đktc) và dung dịch A.
a) Tính % khối lượng của mỗi kim loại trong hỗn hợp ban đầu?
b) Nếu cho lượng khí SO2 thu được ở trên vào 500 ml dd NaOH 1M. Tính nồng độ mol chất trong dd
thu được sau phản ứng? Biết rằng thể tích của dung dịch thay đổi không đáng kể.
c) Cho 500 ml dd BaCl2 1M vào dd A. Sau phản ứng thu được m gan kết tủA. Tính m. Biết rằng lượng
axít dư so với phản ứng là 10%. mọi người giải câu c) dùm em nha các câu trên em làm đc rồi
Đem nung 13,0 gam Cr trong khí
O
2
thì thu được 15,0 gam chất rắn X. Hoà tan hoàn toàn X trong dung dịch
H
2
SO
4
đặc, nóng dư. Thể tích khí
SO
2
(đktc) thu được là A. 4,48 lít B. 6,72 lít C. 8,40 lít. D. 5,60 lít
Đọc tiếp
Đem nung 13,0 gam Cr trong khí O 2 thì thu được 15,0 gam chất rắn X. Hoà tan hoàn toàn X trong dung dịch H 2 SO 4 đặc, nóng dư. Thể tích khí SO 2 (đktc) thu được là
A. 4,48 lít
B. 6,72 lít
C. 8,40 lít.
D. 5,60 lít
Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch H2SO4 loãng thì thể tích NO2 thu được bằng 3 lần thể tích H2 cùng điều kiện, khối lượng muối sunfat bằng 62,81% khối lượng muối nitrat tạo thành. Mặt khác khi nung cùng một lượng kim loại R như trên thì cần thể tích O2 bằng 22,22% thể tích NO2 ở trên cùng điều kiện thu được chất rắn A. Hoà tan 20,88 gam A vào dung dịch HNO3 20% (lấy dư 25% so vói lượng cần thiết) thu được 0,672 lít khí B (dktc) là một oxit của nitơ Nx...
Đọc tiếp
Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch H2SO4 loãng thì thể tích NO2 thu được bằng 3 lần thể tích H2 cùng điều kiện, khối lượng muối sunfat bằng 62,81% khối lượng muối nitrat tạo thành. Mặt khác khi nung cùng một lượng kim loại R như trên thì cần thể tích O2 bằng 22,22% thể tích NO2 ở trên cùng điều kiện thu được chất rắn A. Hoà tan 20,88 gam A vào dung dịch HNO3 20% (lấy dư 25% so vói lượng cần thiết) thu được 0,672 lít khí B (dktc) là một oxit của nitơ NxOy. Khối lượng dung dịch HNO3 đã sử dụng là:
A. 66,15 gam
B. 264,6 gam
C. 330,75 gam
D. 266,4 gam
Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà n N O 2 = 3 n H 2 n ê n n e n h ư ờ n g ( 1 ) = n N O 2 n e n h ư ờ n g ( 2 ) = 2 n H 2
Nên ne nhường(1) =3/2 ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
n e n h ư ờ n g ( 1 ) n e n h ư ờ n g ( 2 ) = n R . h o a t r i 1 n p . h o a t r i 2 = 3 2
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
m R S O 4 = 62 , 81 % m R ( N O 3 ) 2
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là: n NO2= 3nFe=9
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
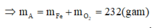
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
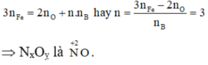
Khi đó:
Đúng 0
Bình luận (0)
Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch H2SO4 loãng thì thể tích NO2 thu được bằng 3 lần thể tích H2 cùng điều kiện, khối lượng muối sunfat bằng 62,81% khối lượng muối nitrat tạo thành. Mặt khác khi nung cùng một lượng kim loại R như trên thì cần thể tích O2 bằng 22,22% thể tích NO2 ở trên cùng điều kiện thu được chất rắn A. Hoà tan 20,88 gam A vào dung dịch HNO3 20% (lấy dư 25% so vói lượng cần thiết) thu được 0,672 lít khí B (dktc) là một oxit của nitơ Nx...
Đọc tiếp
Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch H2SO4 loãng thì thể tích NO2 thu được bằng 3 lần thể tích H2 cùng điều kiện, khối lượng muối sunfat bằng 62,81% khối lượng muối nitrat tạo thành. Mặt khác khi nung cùng một lượng kim loại R như trên thì cần thể tích O2 bằng 22,22% thể tích NO2 ở trên cùng điều kiện thu được chất rắn A. Hoà tan 20,88 gam A vào dung dịch HNO3 20% (lấy dư 25% so vói lượng cần thiết) thu được 0,672 lít khí B (dktc) là một oxit của nitơ NxOy. Khối lượng dung dịch HNO3 đã sử dụng là:
A. 66,15 gam
B. 264,6 gam
C. 330,75 gam
D. 266,4 gam
Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà nên
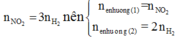
Nên ne nhường(1) = ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
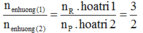
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
![]()
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là:
![]()
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
![]()
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử N + 5 nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:

Þ NxOỵ là .
Khi đó
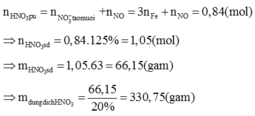
Đúng 0
Bình luận (0)
Hòa tan vừa đủ 13 gam kẽm vào dung dịch chứa a gam axit HCL 15%
a) Viết phương trình phản ứng
b) Tính thể tích khí hidro thu được ở dktc
\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Đúng 2
Bình luận (0)
Zn+2HCl->ZnCl2+H2
0,2--------------------------0,2
nZn=0,2 mol
->VH2=0,2.22,4=4,48l
Đúng 1
Bình luận (0)
`a)PTPƯ: Zn + 2HCl -> ZnCl_2 + H_2↑`
`b) n_[Zn] = 13 / 65 = 0,2 (mol)`
Theo `PTPƯ` có: `n_[H_2] = n_[Zn] = 0,2 (mol)`
`-> V_[H_2] = 0,2 . 22,4 = 4.48 (l)`
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
hoà tan hết 0,2 mol feo bằng dung dịch h2so4 đặc nóng dư thu được khí so2. hấp thụ hoàn toàn khí so2 sinh ra ở trên vào dung dịch chứa 0,07 mol koh và 0,06 mol naoh thu được dung dịch chứa m gam muối .m=?
Bảo toàn electron: \(n_{SO_2}=n_{FeO}:2=0,2:2=0,1mol\)
Nhận thấy \(1< n_{OH}:n_{SO2}=0,13:0,1< 2\Rightarrow\) tạo đồng thời muối trung hòa và muối axit
\(SO_2+OH\rightarrow SO_3^{2-}+H_2O\)
\(X\Rightarrow2X\)
\(SO_2+OH\rightarrow HSO_3\)
\(y\Rightarrow y\)
Ta có hệ:\(\left\{{}\begin{matrix}x+y=0,1\\2x+y=0,13\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}x=0,03\\y=0,07\end{matrix}\right.\)
Dung dịch sau phản ứng chứa: \(Na^+:0,06mol,K^+:0,07mol,SO_3^{2-}:0,03mol,HSO_3:0,07mol\)
Vậy \(m_{muối}=m_{Na^+}+m_{K^+}+m_{SO_3^{2-}}+m_{HSO_3}=12,18gam\)
Đúng 1
Bình luận (0)
Câu 2: Hoà tan hoàn toàn 5,4 gam bột kim loại Al vào 100ml dung dịch H2SO4 CM.a. Tính thể tích khí H2 thu được (đktc)?b. Tính nồng độ mol của axit cần dùng, của dung dịch muối tạo thành .Câu 3: Hoà tan 15,2 gam hỗn hợp Mg và MgO vào lượng dư dung dịch HCl 10%sau phản ứng thu được 6,72 lít H2 (đktc).Tính % về khối lượng của mỗi chất trong hỗn hợp ban đầu?Tính số gam dung dịch HCl đã phản ứng?Tính nồng độ % của dung dịch sau phản ứng?Cho 15,2 gam hỗn hợp Mg và MgO như ở trên tác dụng với lượng dư...
Đọc tiếp
Câu 2: Hoà tan hoàn toàn 5,4 gam bột kim loại Al vào 100ml dung dịch H2SO4 CM.
a. Tính thể tích khí H2 thu được (đktc)?
b. Tính nồng độ mol của axit cần dùng, của dung dịch muối tạo thành .
Câu 3: Hoà tan 15,2 gam hỗn hợp Mg và MgO vào lượng dư dung dịch HCl 10%
sau phản ứng thu được 6,72 lít H2 (đktc).
Tính % về khối lượng của mỗi chất trong hỗn hợp ban đầu?
Tính số gam dung dịch HCl đã phản ứng?
Tính nồng độ % của dung dịch sau phản ứng?
Cho 15,2 gam hỗn hợp Mg và MgO như ở trên tác dụng với lượng dư dung
dịch H2SO4 đặc nóng thì được bao nhiêu lít khí SO2 (đktc)
giúp mình với ạ
a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
______0,2---->0,3------------>0,1------>0,3______(mol)
=> VH2 = 0,3.22,4= 6,72(l)
b) \(C_{M\left(H_2SO_4\right)}=\dfrac{0,3}{0,1}=3M\)
\(C_{M\left(Al_2\left(SO_4\right)_3\right)}=\dfrac{0,1}{0,1}=1M\)
Đúng 2
Bình luận (0)
Câu 3:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ MgO+2HCl\to MgCl_2+H_2O\\ \Rightarrow n_{Mg}=n_{H_2}=0,3(mol)\\ \Rightarrow \%_{Mg}=\dfrac{0,3.24}{15,2}.100\%=47,37\%\\ \Rightarrow \%_{MgO}=100\%-47,37\%=52,63\%\)
\(n_{MgO}=\dfrac{15,2-0,3.24}{40}=0,2(mol)\\ \Rightarrow \Sigma n_{HCl}=0,3.2+0,2.2=1(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1.36,5}{10\%}=365(g)\\ \Sigma n_{MgCl_2}=0,2+0,3=0,5(mol)\\ \Rightarrow C\%_{MgCl_2}=\dfrac{0,5.95}{15,2+365}.100\%=12,49\%\)
\(PTHH:Mg+2H_2SO_{4(đ)}\to MgSO_4+2H_2O+SO_2\uparrow\\ MgO+H_2SO_4\to MgSO_4+H_2O\\ \Rightarrow n_{SO_2}=n_{Mg}=0,3(mol)\\ \Rightarrow V_{SO_2}=0,3.22,4=6,72(l)\)
Đúng 1
Bình luận (0)