Tính thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất sau:
a)SO2
b)Fe2(SO4)3
Tính thành phần % theo khối lượng của nguyên tố oxi có trong hợp chất
Fe2(SO4)3?
\(M_{Fe_2\left(SO_4\right)_3}=400\left(g\text{/}mol\right)\)
\(\%Fe=\dfrac{56\cdot2}{400}\cdot100\%=28\%\)
\(\%S=\dfrac{32\cdot3}{400}\cdot100\%=24\%\)
\(\%O=100-28-24=48\%\)
\(\%m_O=\dfrac{16.12}{400}.100\%=48\%\)
MFe2(SO4)3 = 56 x 2 + 32 x 3 + 16 x 12 = 400 (g/mol)
=> %Fe=56.2400.100%=28%%Fe=56.2400.100%=28%
%S=32.3400.100%=24%%S=32.3400.100%=24%
%O=16.12400.100%=48%
tính phần trăm theo khối lượng mỗi nguyên tố có trong hợp chất Fe2(SO4)3
Tính thành phần phần trăm theo khối lƣợng của các nguyên tố trong hợp chất sau: a) Sắt(III) oxit: Fe2O3 b) Nhôm sunfat : Al2(SO4)3
a) \(\left\{{}\begin{matrix}\%Fe=\dfrac{56.2}{160}.100\%=70\%\\\%O=100\%-70\%=30\%\end{matrix}\right.\)
b) \(\left\{{}\begin{matrix}\%Al=\dfrac{27.2}{342}.100\%=15,79\%\\\%S=\dfrac{32.3}{342}.100\%=28,07\%\\\%O=\dfrac{16.12}{342}.100\%=56,14\%\end{matrix}\right.\)
Hãy xác định thành phần % (theo khối lượng) của các nguyên tố có trong hợp chất: Cu(OH)2; Fe2(SO4)3
bài 2. Xác định thành phần trăm (%) theo khối lượng của các nguyên tố có trong hợp chất.
A/ HNO3
B/ Al2(SO4)3
bài 2. Xác định thành phần trăm (%) theo khối lượng của các nguyên tố có trong hợp chất.
A/ HNO3
B/ Al2(SO4)3
---- CẦN GẤP !!!!!---
\(a,\%H=\dfrac{1}{63}.100\%=1,6\%\\\%N=\dfrac{14}{63}.100\%=22,2\%\\ \%O=100\%-1,6\%-22,2\%=76,2\%\\b,\%Al=\dfrac{54}{342}.100\%=15,8\%\\ \%S=\dfrac{96}{342}.100\%=28,1\%\\ \%O=100\%-15,8\%-28,1\%=56,1\% \%b,b,15,8\%\\ \)
Tìm thành phần phần trăm (theo khối lượng) các nguyên tố hóa học có trong những hợp chất sau:
a) CO và CO2.
b) Fe3O4 và Fe2O3.
c) SO2 và SO3.
a) Hợp chất CO có MCO = 12 + 16 = 28 g/mol
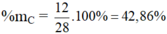
%mO = 100 – 42,86 = 57,14%
Hợp chất CO2: có MCO2 = 12 + 32 = 44 g/mol
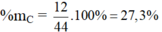
%mO = 100 – 27,3 = 72,7%
b) Hợp chất Fe3O4: MFe3O4 = 3.56 + 4.16 = 232 g/mol
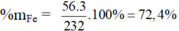
%mO = 100 – 72,4 = 27,6%
Hợp chất Fe2O3: MFe2O3 = 2.56 + 3.16 = 160 g/mol
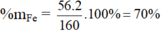
%mO = 100 – 70 = 30%
c) Hợp chất SO2 : MSO2 = 32 + 2.16 = 64 g/mol
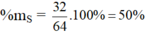
%mO = 100 – 50 = 50%
Hợp chất SO3 : MSO3 = 32 + 16.3 = 80 g/mol
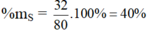
%mO = 100 – 40 = 60%
Thành phần phần trăm theo khối lượng của nguyên tố Sulfur S trong hợp chất SO2 là
\(M_{SO_2}=32+16.2=64\left(\dfrac{g}{mol}\right)\\ \Rightarrow\%S=\dfrac{M_S}{M_{SO_2}}=\dfrac{32}{64}=0,5=50\%\)
tìm thành phần phần trăm(theo khối lượng)các nguyên tố hoá học có trong những hợp chất sau:
a,CO và CO2 b,Fe3O4 và Fe2O3 c,SO2 vàSO3
a/
+ CO
%mC = \(\frac{12}{12+16}.100\%=42,86\%\)%mO = 100% - 42,86% =57,14%+CO2
%mC = \(\frac{12}{12+16.2}.100\%=27,27\%\) %mO = 100% - 27,27% = 72,73%b/
+Fe3O4
%mFe = \(\frac{56.3}{56.3+16.4}.100\%=72,41\%\) %mO = 100% - 72,41% = 27,59%+ Fe2O3
%mFe = \(\frac{56.2}{56.2+16.3}.100\%=70\%\) %mO = 100% - 70% = 30%c/
+SO2
%mS = \(\frac{32}{32+16.2}.100\%=50\%\)%mO = 100% - 50% = 50%+ SO3
%mS = \(\frac{32}{32+16.3}.100\%=40\%\) %mO = 100% - 40% = 60%
Công thức hoá học của sulfur dioxide là SO2.
a. Hãy cho biết số lượng nguyên tử của mỗi nguyên tố có trong phân tử đó.
b. Tính khối lượng phân tử
c. Tính thành phần phần trăm khối lượng các nguyên tố có trong hợp chất
`#3107.101107`
a. Sửa đề: Hãy cho biết khối lượng nguyên tử của mỗi nguyên tố có trong phân tử đó.
- Trong phân tử \(\text{SO}_2\) gồm 2 nguyên tử, nguyên tử S và O
`=>` NTK của S là `32` amu, NTK của phân tử O là `16` amu
b.
Khối lượng phân tử của SO2 là:
\(32+16\cdot2=64\left(\text{amu}\right)\)
c.
Số `%` của S có trong SO2 là:
\(\text{%S }=\dfrac{32\cdot100}{64}=50\left(\%\right)\)
Số `%` của O2 có trong SO2 là:
\(\text{%O = 100%}-\text{50% = 50%}\)
Vậy:
a. S: `32` amu, O: `16` amu
b. PTK của SO2 là `64` amu
c. \(\text{%S = 50%; %O = 50%.}\)