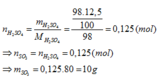Tính nồng độ % của dung dịch thu được khi hòa tan16g SO3 vào 480ml nước.

Những câu hỏi liên quan
Tính nồng độ H+ trong dung dịch thu được khi hòa tan 8 gam SO3 vào 200ml nước? A. 0,1M B. 0,5M C. 1M D. 1,2M
Đọc tiếp
Tính nồng độ H+ trong dung dịch thu được khi hòa tan 8 gam SO3 vào 200ml nước?
A. 0,1M
B. 0,5M
C. 1M
D. 1,2M
Đáp án C
SO3+ H2O→ H2SO4
n H 2 S O 4 = n S O 3 = 0,1 mol; nH+= 0,2 mol; [H+]= 0,2/0,2=1M
Đúng 0
Bình luận (0)
Hòa tan 12 gam SO3 vào 100g nước để được dung dịch H2SO4. Tính nồng độ phần trăm của dung dịch H2SO4 thu được
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{SO_3}=\dfrac{12}{80}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{SO_3}=0,15\left(mol\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{0,15.98}{12+100}.100\%=13,125\%\)
Đúng 1
Bình luận (0)
Hòa tan 320 g SO3 vào 480 ml nước. Hãy xác định nồng độ phần trăm của dung dịch thu được ? Nêu hiện tượng xảy ra khi nhúng quỳ tím vào dung dịch thu được ?
PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{320}{80}=4\left(mol\right)=n_{H_2SO_4}\) \(\Rightarrow C\%_{H_2SO_4}=\dfrac{4\cdot98}{320+480}\cdot100\%=49\%\)
Dung dịch sau p/ứ làm quỳ tím hóa đỏ
Đúng 3
Bình luận (0)
gì mà 4 mol SO3 lận z
nSO3=4(mol)
PTHH: SO3 + H2O -> H2SO4
mH2O=480(g) => mddH2SO4=mSO3 + mH2O=800(g)
nH2SO4=nSO3=4(mol) => mH2SO4=392(g)
=> C%ddH2SO4= (392/800).100=49%
=> QUỲ TÍM HÓA ĐỎ LÈ LÈ NÈ
Đúng 2
Bình luận (0)
hòa tan 5,6 lít SO3 (đktc) vào 100g nước thu được dung dịch A
a)nồng độ phần trăm của dung dịch A
b)thể tích dung dịch KOH 2M cần trung hòa hết dung dịch A
Ta có: \(n_{SO_3}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(a,PTHH:SO_3+H_2O--->H_2SO_4\left(1\right)\)
Ta lại có: \(m_{dd_A}=0,25.80+100=120\left(g\right)\)
Theo PT(1): \(n_{H_2SO_4}=n_{SO_3}=0,25\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,25.98=24,5\left(g\right)\)
\(\Rightarrow C_{\%_A}=\dfrac{24,5}{120}.100\%=20,42\%\)
\(b.PTHH:2KOH+H_2SO_4--->K_2SO_4+2H_2O\left(2\right)\)
Theo PT(2): \(n_{KOH}=2.n_{H_2SO_4}=2.0,25=0,5\left(mol\right)\)
\(\Rightarrow V_{dd_{KOH}}=\dfrac{0,5}{2}=0,25\left(lít\right)\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 32gam SO3 vào 200gam dung dịch H2SO4 có nồng độ 10%. Tính C% của dung dịch thu được.
\(n_{SO_3}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=n_{SO_3}=0,4\left(mol\right)\)
\(m_{H_2SO_4}=0,4\cdot98=39,2\left(g\right)\)
\(m_{H_2SO_4\text{ trong dd 10%}}=\dfrac{200\cdot10}{100}=20\left(g\right)\)
\(\sum m_{H_2SO_4}=20+39,2=59,2\left(g\right)\)
\(m_{\text{ dd H2SO4 10%}}=200+39,2=239,2\left(g\right)\)
\(C\%_{\text{ dd mới}}=\dfrac{59,2}{239,2}\cdot100\%\approx24,75\%\)
Hiện tượng: SO3 được đưa vào dd H2SO4, SO3 tác dụng với H2O trong dd tạo ra sản phẩm là H2SO4.
Đúng 1
Bình luận (0)
bài toán tính nồng độ%
a) tính nồng độ phần trăm của dung dịch natri clorua khi hòa tan 20 gam muối natri clorua vào 180 gam nước
b) hòa tan 16 gam CuSO4 vào nước thu được dung dịch Cu SO4 20%. Hãy tính khối lượng dung dịch thu được và khối lượng nước cần dùng ?
a)
Khối lượng của dung dịch:
\(m_{dd}=m_{ct}+m_{dm}=20+180=200\left(g\right)\)
Nồng độ phần trăm của dung dịch:
\(C\%=\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{20}{200}.100\%=10\%\)
b) đề sai nha bạn
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 24 gam SO3 vào nước, thu được dung dịch X có nồng độ 20% (loãng, khối lượng riêng là 1,14 g/ml).
a) Tính thể tích dung dịch X thu được.
b) Hòa tan m gam Fe vào dung dịch X ở trên, phản ứng xảy ra vừa đủ, sau phản ứng thu được dung dịch T và V lít khí (ở 25 độ C và 1 bar).
- Tính các giá trị của m và V.
- Tính nồng độ phần trăm của dung dịch T.
a) PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{24}{80}=0,3\left(mol\right)=n_{H_2SO_4}\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,3\cdot98}{20\%}=147\left(g\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{147}{1,14}\approx128,95\left(ml\right)\)
b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Fe}=n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)=n_{FeSO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,3\cdot56=16,8\left(g\right)\\V_{H_2}=0,3\cdot24,76=7,428\left(l\right)\\m_{FeSO_4}=0,3\cdot152=45,6\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Fe}+m_{ddH_2SO_4}-m_{H_2}=163,2\left(g\right)\)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{45,6}{163,2}\cdot100\%\approx27,94\%\)
Đúng 1
Bình luận (0)
Cho 2,24 lít khí SO3 (đktc) hòa tan vào nước thu được 500ml dung dịch axit sunfuric(H2SO4)
a) Tính nồng độ mol của dung dịch axit H2SO4.
b)Tính khối lượng Zn có thể phản ứng hết với axit có trong dung dịch trên?
a, PTPƯ: SO3 + H2O ---> H2SO4
nSO3=\(\dfrac{2,24}{22,4}=0,1mol\)
1 mol SO3 ---> 0,1 mol H2SO4
nên 0,1 mol SO3 ---> 0,1 mol H2SO4
CM H2SO4=\(\dfrac{0,1}{0,5}\)=0,2 M
b, PTPƯ: Zn + H2SO4 ---> ZnSO4 + H2
1 mol H2SO4 ---> 1 mol Zn
nên 0,1 mol H2SO4 ---> 0,1 mol Zn
mZn=0,1.65=6,5 g
Đúng 1
Bình luận (0)
Hòa tan hết m gam
S
O
3
vào nước thu được 98 gam dung dịch axit sunfuric có nồng độ 12,5%. Khối lượng m gam
S
O
3
là: A. 20g B. 15g C. 25g D. 10g
Đọc tiếp
Hòa tan hết m gam S O 3 vào nước thu được 98 gam dung dịch axit sunfuric có nồng độ 12,5%. Khối lượng m gam S O 3 là:
A. 20g
B. 15g
C. 25g
D. 10g