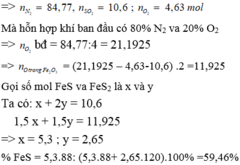Nung 12g FeS2 trong bình kín chứa 16,8 lít không khí thu được SO2 va Fe2O3.
a, Viết PTHH
b, Tính thể tích SO2 và khối lượng Fe2O3 thu được?
nung m gam FeS2 trong bình chứa đầy khí O2 dư . Sau khi phản ứng xảy ra hoàn toàn ,thu được Fe2O3 và 8,96 lít SO2 ( đktc). a,viết PTHH b,Tính m
a)
$4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2$
b)
$n_{SO_2} = \dfrac{8,96}{22,4} = 0,4(mol)$
Theo PTHH :
$n_{FeS_2} = \dfrac{1}{2}n_{SO_2} = 0,2(mol)$
$m = 0,2.120 = 24(gam)$
a,\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: FeS2 + O2 → Fe2O3 + SO2
Mol: 0,4 0,4
\(m_{FeS_2}=0,4.120=48\left(g\right)\)
nung 17,8g hỗn hợp X gồm FeS và FeS2 trong bình kín chứa đầy oxi dư. Sau khi các phản ứng xảy ra hoàn toàn thu được chất rằn duy nhất là Fe2O3 và 5,6 lít SO2 (đktc)
a. tính khối lượng mỗi chất trong X
b. tính thể tích khí oxi (đktc) tối thiểu cần dùng để phản ứng hết với 17,8g hỗn hợp X
a, PT: \(4FeS+7O_2\underrightarrow{t^o}2Fe_2O_3+4SO_2\)
\(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
Giả sử: \(\left\{{}\begin{matrix}n_{FeS}=x\left(mol\right)\\n_{FeS_2}=y\left(mol\right)\end{matrix}\right.\)
⇒ 88x + 120y = 17,8 (1)
Ta có: \(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_{SO_2}=n_{FeS}+2n_{FeS_2}=x+2y\left(mol\right)\)
⇒ x + 2y = 0,25 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,075\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeS}=0,1.88=8,8\left(g\right)\\m_{FeS_2}=0,075.120=9\left(g\right)\end{matrix}\right.\)
b, Theo PT: \(n_{O_2}=\dfrac{7}{4}n_{FeS}+\dfrac{11}{4}n_{O_2}=0,38125\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,38125.22,4=8,54\left(l\right)\)
Bạn tham khảo nhé!
a) Gọi nFeS = a (mol)
\(n_{FeS_2}=b\left(mol\right)\) với a; b > 0
\(n_{SO_2}=\dfrac{V}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}m_{hh}=17,8=m_{FeS}+m_{FeS_2}=88a+120b\\n_{S\left(SO_2\right)}=0,25=n_{FeS}+2n_{FeS_2}\left(bt\left[S\right]\right)=a+2b\end{matrix}\right.\)
=> a = 0,1(mol); b = 0,075(mol)
mFeS= n.M= 0,1 . 88 = 8,8(g)
=> \(m_{FeS_2}=m_{hh}-m_{FeS}=17,8-8,8=9\left(g\right)\)
b) PT:
\(4FeS+7O_2\underrightarrow{t^o}2Fe_2O_3+4SO_2\uparrow\\ 4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\uparrow\)
\(Theo2pt\Rightarrow n_{O_2}=\dfrac{7n_{FeS}+11n_{FeS_2}}{4}=0,38125\left(mol\right)\)
\(\Rightarrow V_{O_2}=n\cdot22,4=0,38125\cdot22,4=8,54\left(l\right)\)
Nung nóng hỗn hợp X gồm FeS và FeS2 trong bình kín chứa không khí (gồm 20% thể tích O2 và 80% thể tích N2) đến khi phản ứng xảy ra hoàn toàn, thu được Fe2O3 duy nhất và hỗn hợp khí Y gồm N2, SO2 và O2 có tỉ lệ mol tương ứng 16:2:1. Phần trăm khối lượng của FeS trong X là
A. 59,46%
B. 42,31%
C. 68,75%
D. 26,83%
Đốt cháy 400g quặng Pirit sắt (FeS2) chứa 10% tạp chất trong khí O2. Thu được SO2 và Fe2O3. a) Tính thể tích SO2 (đktc) b) Phân loại 2 oxit tạo thành
\(m_{FeS_2}=400.\left(100-10\right)\%=360\left(g\right)\\ \rightarrow n_{FeS_2}=\dfrac{360}{120}=3\left(mol\right)\)
PTHH: 4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
3 3
\(\rightarrow V_{SO_2}=6.22,4=134,4\left(l\right)\)
Fe2O3 oxit bazo, SO2 oxit axit
Một hỗn hợp gồm FeO và Fe2O3 có khối lượng 30,4g. Nung hỗn hợp này trong một bình kín có chứa 22,4 lít khí CO ở DKTC thu được hỗn hợp khí có khối lượng là 36g.
a. Viết PTHH của phản ứng.
b. Tính % theo Thể tích của các khí có trong hỗn hợp sau phản ứng biết toàn bộ oxit sắt đều bị khử thành kim loại.
Đốt cháy hoàn toàn 44,8 gam hỗn hợp gồm FeS và FeS2 trong V lít không khí (đktc) vừa đủ (không khí có 20% thể tích là O2, 80% thể tích là N2), thu được m gam Fe2O3 và V’ lít hỗn hợp khí (đktc) gồm N2 và SO2, trong đó SO2 chiếm 14,89% về thể tích.
a/ Viết PTHH.
b/ Tìm V.
c/ Tính khối lượng từng chất trong hỗn hợp đầu.
d/ Tìm m.
Nung m gam hỗn hợp X gồm FeS và FeS2 trong một bình kín chứa không khí (gồm 20% thể tích O2 và 80% thể tích N2) đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn và hỗn họp khí Y có thành phần thể tích: N2 = 84,77%; SO2 = 10,6%; còn lại là O2. Thành phần % theo khối lượng của FeS trong X là:
A. 59,46%.
B.42,3%.
C.68,75%.
D. 26,83%.
Đáp án A
Chọn 100 mol không khí.
Tỉ lệ thể tích cũng là tỉ lệ số mol nên
![]()
Gọi 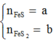
Có
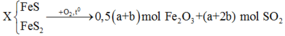

![]()
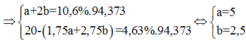
Nung m gam hỗn hợp X gồm FeS và FeS2 trong một bình kín chứa không khí (gồm 20% thể tích O2 và 80% thể tích N2) đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn và hỗn hợp khí Y có thành phần thể tích: N2 = 84,77%; SO2 = 10,6%; còn lại là O2. Thành phần % theo khối lượng của FeS trong X là
A. 68,75%
B. 59,46%
C. 26,83%
D. 42,30%
Đáp án : B
Xét 1 mol không khí : 0,2 mol O2 và 0,8 mol N2
%nN2 = 84,77% => nY = 0,94373 mol
=> nSO2 = 0,1 mol
,nO2 dư = 0,0437 mol
=> nO2 pứ = 0,2 – 0,044 = 0,1563 mol
2FeS + 3,5O2 -> Fe2O3 + 2SO2
.a -> 1,75a
2FeS2 + 5,5O2 -> Fe2O3 + 4SO2
.b -> 2,75b
=> ¼ (7a + 11b) = 0,1563
.a + 2b = 0,1
=> a = 0,05 mol ; b = 0,025 mol
=> mX = 7,4g
=> %mFeS = 59,46%
Nung m gam hỗn hợp X gồm FeS và FeS2 trong một bình kín chứa không khí (gồm 20% thể tích O2 và 80% thể tích N2) đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn và hỗn hợp khí Y có thành phần thể tích: N2 = 84,77%; SO2 = 10,6% còn lại là O2. Thành phần % theo khối lượng của FeS trong X là
A. 68,75%
B. 59,46%
C. 26,83%
D. 42,3%
Đáp án B
Giả sử có 100 mol hỗn hợp khí Y