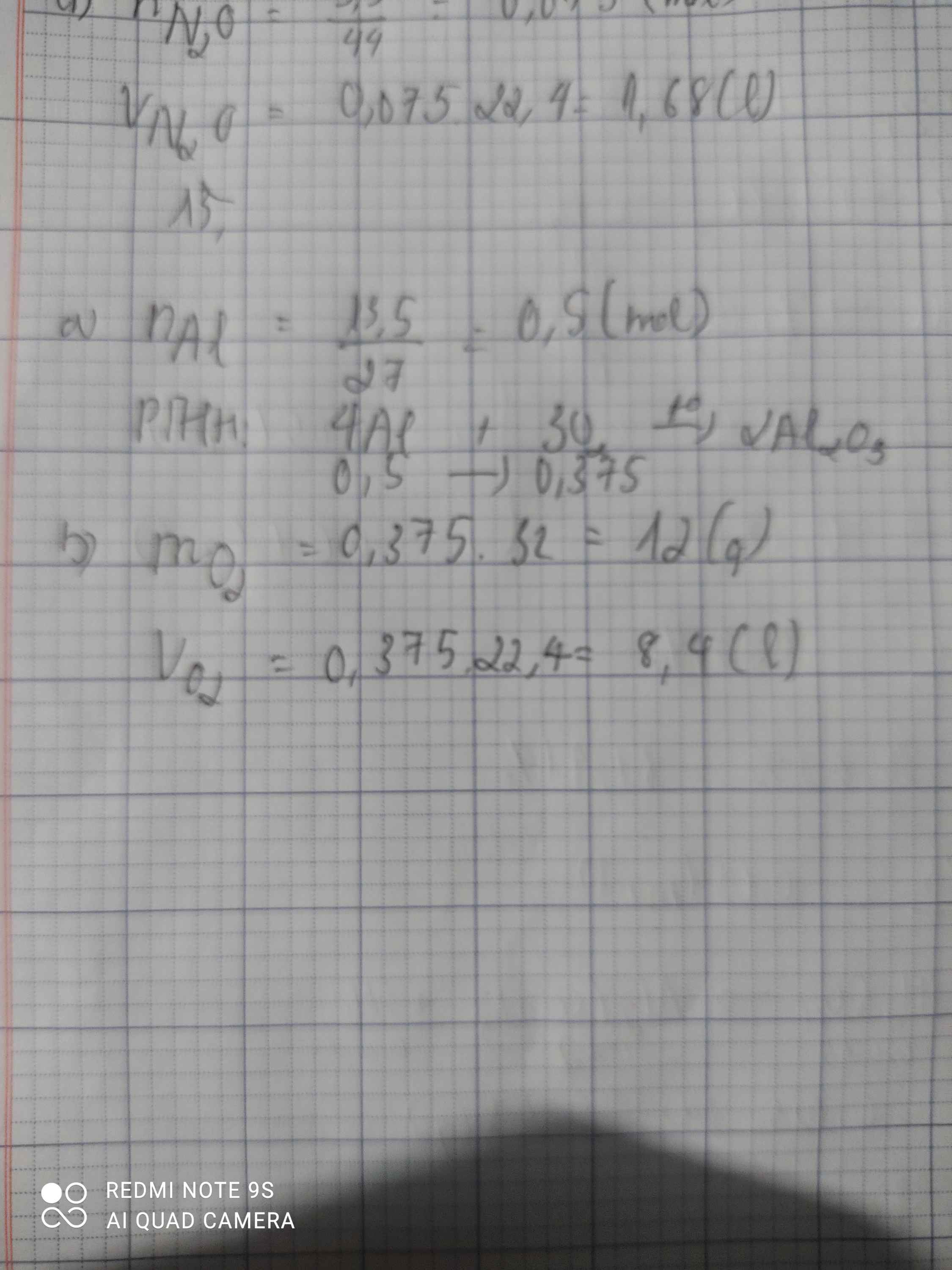cho 2.7 g nhôm tác dụng với 3.36l khi oxi ở đktc tính khối lượng của những chất còn sau p/ứng hóa học sảy ra

Những câu hỏi liên quan
cho 32,4 gam kim loại nhôm tác dụng với 23,7984 lít khí oxi (đkt)
a.chất nào còn dư sau phản ứng
b.tính khối lượng nhôm oxit tạo thành sau phản ứng
c.cho toàn bộ lượng khí kim loại nhôm ở trên vào dung dịch axit HCL .Sau khi phản ứng sảy ra hoàn toàn thu đc bao nhiêu lít khí H2 ở (đkt)
n Al=\(\dfrac{32,4}{27}\)=1,2 mol
n O2=\(\dfrac{23,7984}{22,4}\)=1,062mol
4Al+3O2-to>2Al2O3
1,2---------------0,6 mol
O2 dư
=>m Al2O3=0,6.102=61,2g
2Al+6HCl->2AlCl3+3H2
1,2-----------------------1,8 mol
=>VH2=1,8.22,4=40,32l
Đúng 3
Bình luận (0)
cho 5,4 g nhôm tác dụng vừa đủ với khí oxi thu được nhôm oxit theo phương trình hóa học sau :4Al+3O2->2Al2O3
a) tính khối lượng nhôm oxit (Al2O3) tạo thành
b)tính thể tích khí oxi(đktc) tham gia phản ứng
Làm gộp cả phần a và b
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,15mol\\n_{Al_2O_3}=0,1mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\\m_{Al_2O_3}=0,1\cdot102=10,2\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Cho 13,5g kim loại nhôm tác dụng với 8,96l khí oxi ở đktc. Khối lượng của nhôm oxit sau khi phản ứng kết thúc là :
A. 49,25 g ; B. 79,0 g ; C. 25,5 g ; D. 39.5 g
Số mol Al=0,5mol
Số mol O2= 8,96/22,4=0,4 mol
4Al +3O2->2Al2O3
0,5. 0,4
TA CÓ 0,5/4 < 0,4/3
=> oxi dư
4Al+ 3O2-> 2Al2O3
0,5. 0,25
m(Al2O3)= 0,25.102=25,5g
Chọn C
Đúng 3
Bình luận (0)
Số mol của nhôm
nAl = \(\dfrac{m_{Al}}{M_{Al}}=\dfrac{13,5}{27}=0,5\left(mol\right)\)
Số mol của khí oxi ở dktc
nO2 = \(\dfrac{V_{O2}}{22,4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Pt : 4Al + 3O2 → 2Al2O3\(|\)
4 3 2 0,5 0,4 0,25
Lập tỉ số so sánh : \(\dfrac{0,5}{4}>\dfrac{0,4}{3}\)
⇒ Al phản ứng hết, O2 dư
⇒ Tính toán dựa vào số mol Al
Số mol của nhôm oxit
nAl2O3 = \(\dfrac{0,5..2}{4}=0,25\left(mol\right)\)
Khối lượng của nhôm
mAl2O3 = nAl2O3 . MAl2O3
= 0,25 . 102
= 25,5 (g)
⇒ Chọn câu : C
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Cho 13,5 g kim loại al tác dụng với o2 sinh ra nhôm axit a) viết phản ứng hóa học b) tính khối lượng và thể tích của oxi tham gia phản ứng
\(n_{Al}=\dfrac{13,5}{27}=0,5\left(mol\right)\\a, 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ n_{O_2}=\dfrac{3}{4}.0,5=0,375\left(mol\right)\\ m_{O_2}=32.0,375=12\left(g\right)\\ V_{O_2\left(đktc\right)}=0,375.22,4=8,4\left(l\right)\)
Đúng 3
Bình luận (3)
Bài 1:Cho sơ đồ phản ứng sau: Mg + HCl -MgCl2 + H2Nếu cho 2,4g Mg tác dụng với 3,65g HCl. Chất nào còn dư sau phản ứng? Tính khối lượng còn dư? Tính khối lượng MgCl2 tạo thành và thể tích khí H2 thu được (đktc)Bài 2:Cho sơ đồ phản ứng sau: Al + H2SO4 - Al2(SO4)3 + H2Nếu có 5,4g nhôm tác dụng với 14,7g H2SO4. Chất nào còn dư sau phản ứng? Tính khối lượng còn dư? Tính khối lượng Al2(SO4)3 tạo thành và thể tích khí H2 thu được (đktc)Bài 3: Hòa tan hoàn toàn 3,78g với kim loại M (hóa trị III) vào d...
Đọc tiếp
Bài 1:
Cho sơ đồ phản ứng sau: Mg + HCl ->MgCl2 + H2
Nếu cho 2,4g Mg tác dụng với 3,65g HCl. Chất nào còn dư sau phản ứng? Tính khối lượng còn dư? Tính khối lượng MgCl2 tạo thành và thể tích khí H2 thu được (đktc)
Bài 2:
Cho sơ đồ phản ứng sau: Al + H2SO4 -> Al2(SO4)3 + H2
Nếu có 5,4g nhôm tác dụng với 14,7g H2SO4. Chất nào còn dư sau phản ứng? Tính khối lượng còn dư? Tính khối lượng Al2(SO4)3 tạo thành và thể tích khí H2 thu được (đktc)
Bài 3:
Hòa tan hoàn toàn 3,78g với kim loại M (hóa trị III) vào dung dịch HCl thu được 4,704l khí H2 (đktc). Xác định kim loại M?
Bài 4:
Cho sơ đồ phản ứng sau: KMnO4 -> ..........+...........+O2
Tính thể tích Oxi (đktc) thu được khi nhiệt phân hủy hoàn toàn 0,4 mol KMnO4
Đốt cháy 6,2g photpho trong bình chứa lượng Oxi ở trên. Tính khối lượng điphotpho pentaoxit?
bạn từng câu lên sẽ dễ nhìn hơn
1,Tính khối lượng 5,6 lít O_2(đktc)2,Cho phản ứng hóa học sauFe_2O_3+HClrightarrow FeCl_3+H_2O. Tổng hệ số cân bằng của phương trình là bao nhiêu ?3,Cho 32,4g kim loại nhôm tác dụng nói 21,504 lít khí oxi ở điều kiện tiêu chuẩna, Chất nào còn dư sau phản ứng? Khối lượng chất còn dư là bao nhiêu g?b, Tính khối lượng nhôm oxit tạo thành sau phản ứngc, Cho toàn bộ lượng kimloaij nhôm ở trên vào dung dịch axit HCl. Sau khi phản ứng xảy ra hoàn toàn thu được bao nhiêu lít khí H_2 ở dktc
Đọc tiếp
1,Tính khối lượng 5,6 lít \(O_2\)(đktc)
2,Cho phản ứng hóa học sau
\(Fe_2O_3+HCl\rightarrow FeCl_3+H_2O\). Tổng hệ số cân bằng của phương trình là bao nhiêu ?
3,Cho 32,4g kim loại nhôm tác dụng nói 21,504 lít khí oxi ở điều kiện tiêu chuẩn
a, Chất nào còn dư sau phản ứng? Khối lượng chất còn dư là bao nhiêu g?
b, Tính khối lượng nhôm oxit tạo thành sau phản ứng
c, Cho toàn bộ lượng kimloaij nhôm ở trên vào dung dịch axit HCl. Sau khi phản ứng xảy ra hoàn toàn thu được bao nhiêu lít khí \(H_2\) ở dktc
1/
Áp dụng công thức: \(m=n.M=>n=\dfrac{m}{M}\)
\(=>n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{5.6}{32}=0.175\left(mol\right)\)
\(=>V_{O_2}=0.175\cdot22.4=3.92\left(l\right)\)
Vậy...
Đúng 1
Bình luận (1)
1. n\(O_2\)=\(\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
=> \(m_{O_2}=0.25\cdot32=8\left(g\right)\)
2.Tổng hệ số cân bằng là 1+6+2+3=12
Đúng 2
Bình luận (0)
\(n_{Al}=\dfrac{32.4}{27}=1.2\left(mol\right)\)
\(n_{O_2}=\dfrac{21.504}{22.4=0.96}=\left(mol\right)\)
4Al+3O2->2Al2O3
TPU 1,2 0,96
PU 1,2 0,9 0,6
SPU 0 0,06 0,6
=> O2 dư
mO2=0,06x32=1,92 g
Đúng 1
Bình luận (0)
Cho 5,4 g nhôm tác dụng với 49 g dung dịch axit sunfuric a) viết ptpư xảy ra b) chất nào còn dư sao phản ứng và khối lượng dư là bao nhiêu ? c) tính thể tích khí H2 thu được ở đktc
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{49}{98}=0.5\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(0.2........0.3.................................0.3\)
\(m_{H_2SO_4\left(dư\right)}=\left(0.5-0.3\right)\cdot98=19.6\left(g\right)\)
\(V_{H_2}=0.3\cdot22.4=6.72\left(l\right)\)
Đúng 0
Bình luận (0)
Nhiệt phân hoàn toàn 31,6 g kalipemanganat sinh ra V (lít) khí ở đktc
a. Viết các PTHH xảy ra. Tìm V.
b. Cho toàn bộ lượng khí oxi thu được ở trên tác dụng với 7,2 g magie. Chất nào còn dư sau khi phản ứng của oxi với magie, khối lượng chất dư là bao nhiêu gam? Tính khối lượng chất rắn sau phản ứng.
Mn giúp e với ạ
PTHH:
2KMnO4 -to> K2MnO4 + MnO2 + O2
0,2------------------------------------------0,1
n KMnO4=\(\dfrac{31,6}{158}\)=0,2 mol
=>VO2=0,1.22,4=2,24l
b)2Mg+O2-to>2MgO
0,2----0,1----0,2
n Mg=\(\dfrac{7,2}{24}\)=0,3 mol
=>Mg dư :0,1 mol
=>mMg=0,1.24=2,4g
=>m MgO=0,2.40=8g
Đúng 3
Bình luận (0)
Cho m gam axit HCl tác dụng hết với 100ml dd NaOH 1M a, viết PTHH sảy ra? Cho biết loại phản ứng hoá học? b, Tính m? c,Tính khối lượng muối tạo thành sau phản ứng? d,Nếu cho 73g dd HCl 10% tác dụng với lượng dd NaOH trên thì sau phản ứng chất nào còn dư và khối lượng bằng bao nhiê
\(a.HCl+NaOH\rightarrow NaCl+H_2O\)
PỨ trung hoà
\(b,n_{NaOH}=0,1.1=0,1mol\\ n_{NaCl}=n_{NaOH}=n_{HCl}0,1mol\\ m=m_{HCl}=0,1.36,5=3,65g\\ c,m_{NaCl}=0,1.58,5=5,85g\\ d,n_{HCl}=\dfrac{73.10}{100.36,5}=0,2mol\\ \Rightarrow\dfrac{0,1}{1}< \dfrac{0,2}{1}\Rightarrow HCl.dư\\ n_{HCl,pứ}=n_{NaOH}=0,1mol\\ m_{HCl,dư}=\left(0,2-0,1\right).36,5=3,65g\)
Đúng 1
Bình luận (0)