trộn dd chứa 1g NaOH vào dd chứa 1g axit H2SO4. Hỏi dd thu được chứa PH>7,PH<7 và PH=7

Những câu hỏi liên quan
dd A có chứa 1g NaOH ,dd B chứa 1g HCl . Đổ dd A vào dd B thì thu được dd C. Hãy chi biết pH của dd C nằm trong khoảng nào ? giải thích
\(n_{NaOH}=\dfrac{1}{40}mol\)
\(n_{HCl}=\dfrac{1}{36,5}=\dfrac{2}{73}mol\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(\dfrac{1}{40}\) \(\dfrac{2}{73}\)
\(\Rightarrow HCl\) dư và dư 0,002mol.
Vậy khả năng ddC có \(pH< 7\)
Đúng 0
Bình luận (2)
Đổ dd chứa 1g HBr vào dd chứa 1g NaOH. Nhúng giấy quì tím vào dung dịch thu được thì giấy quì tím chuyển sang màu:
A. Màu đỏ
B. Màu xanh
C. Không màu
D. Màu tím
Đáp án B.
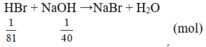
=>NaOH dư, HBr phản ứng hết => dung dịch làm quỳ chuyển sang màu xanh.
Đúng 0
Bình luận (0)
Đổ đ chứa 1 g HBr vào dd chứa 1g NaOH . Nhúng giấy quì tím vào dd thu đk thì giấy quì chuyển màu gì
: Đầu tiên ta tốh số mol của hai chất trên, n của HBr= 1/81
n của NaOH = 1/40 như vậy số mol của NaOH nhiều hơn của HBr
suy ra NaOH dư, tạo môi trường OH, Vậy quỳ chuyển màu xanh nếu thể tích không quá lớn nha, lớn quá thì màu nhạt rùi khỏi thấy luôn hì hì.
Đúng 0
Bình luận (0)
Dd A chứa 1g NaOH , ddB chứa 1g HCl , đổ dd A vào dd B thì thu đc dd C . Dd C làm quỳ tím đổi sang màu j ? Vì sao ?
Dd A chứa 1g NaOH , ddB chứa 1g HCl , đổ dd A vào dd B thì thu đc dd C
Ta có PTHH :
NaOH + HCl \(\rightarrow\) NaCl + H2O
Dung dịch C thu được là NaCl
Vì NaCl là muối nên không làm quỳ tím đổi màu , chỉ có dung dcihj bazo và dung dịch axit mới làm quỳ tím đổi màu
Đúng 0
Bình luận (12)
Cho dd X chứa H2SO4 nồng độ xM, dd Y chứa NaOH nồng độ yM. Trộn 100ml dd X với 200ml dd Y thu được 300ml dd Z. Để trung hòa được 100ml dd Z cần 80ml dd HCl nồng độ 0,5M. Mặt khác, trộn 200ml dd X với 100ml dd Y thu được 300ml dd T. Biết rằng 100ml dd T tác dụng vừa đủ với 0,405g Al. Xác định x và y.
Đọc tiếp
Cho dd X chứa H2SO4 nồng độ xM, dd Y chứa NaOH nồng độ yM.
Trộn 100ml dd X với 200ml dd Y thu được 300ml dd Z. Để trung hòa được 100ml dd Z cần 80ml dd HCl nồng độ 0,5M.
Mặt khác, trộn 200ml dd X với 100ml dd Y thu được 300ml dd T. Biết rằng 100ml dd T tác dụng vừa đủ với 0,405g Al.
Xác định x và y.
2 / Trộn 120 ml dd H2SO4 với 40 ml dd NaOH, dd sau khi trộn chứa 1 muối Axit và còn dư H2SO4 nồng độ 0,1 M. mặt khác nếu trộn 40 ml H2SO4 với 60 ml dd NaOH thì trong dd sau khi trộn còn dư dd NaOH có nồng độ 0,16 M . Xác định CM của 2 dd H2SO4, NaOH ban đầu
Gọi a,b lần lượt là CM của H2SO4 và NaOH
Thí nghiệm 1: bazơ hết, axit dư
H2SO4 + NaOH -> NaHSO4 + H2O
0,12a -> 0,04b
nH2SO4 dư = 0,1*(0,12 + 0,04) = 0,016 (mol)
Ta có: 0,12a - 0,04b = 0,016 (1)
Thí nghiệm 2: bazơ dư, axit hết
H2SO4 + 2NaOH -> Na2SO4 + 2H2O
0,04a -> 0,06b
0,04a -> 0,08a
nNaOH dư = 0,16 *(0,04 + 0,06) = 0,016 (mol)
Vậy 0,06b - 0,08a = 0,016 (2)
Từ (1) và (2), ta được:
x = 0,4
y = 0,8
Vậy CM H2SO4 = 0,4M
CM NaOH = 0,8M
Đúng 1
Bình luận (0)
Đặt x ; y là nồng độ mol của H2SO4 và NaOH
Phần đầu
NaOH + H2SO4 --> NaHSO4 + H2O
0,04y 0,12x
n H2SO4 dư = 0,1.( 0,12 + 0,04 ) = 0,016 (mol)
=> 0,12x - 0.04y = 0,016 (1)
Phần sau
2NaOH + H2SO4 --> Na2SO4 + 2H2O
0,06y 0,04x
0,08x <-----0,04x
n NaOH dư = 0,16( 0,04 + 0,06 ) = 0,016 (mol)
=> 0,06y - 0,08x = 0,016 (2)
Từ (1) ; (2) lập hệ pt :
{ 0,12x - 0.04y = 0,016
{0,06y - 0,08x = 0,016
{ x = 2/5
{ y = 4/5
Đúng 0
Bình luận (0)
Trộn dd A chứa NaOH và dd B chứa Ba(OH)2 theo thể tích bằng nhau được dd C. Trung hòa 100ml cần dùng hết 35 ml dd H2SO4 2M và thu được 9.32 gam kết tủa. Tính nồng độ mol của các dd A và B. Cần phải trộn bao nhiêu ml dd B với 20 ml ddA để thu được dd hòa tan vừa hết 1.08 gam Al.
gọi số mol của NaOH = x , Ba(OH)2 = y . số mol OH- = x + 2y
pt : H+ + OH- → H2O
nH+ =2. 0,035. 2=0,14 mol = x+ 2y
khối lượng kết tủa = mSO42- + mBa2+ = 96.0.07 + 137.y= 9,32 =>y=0,02 => x= 0,1
nồng độ tự tính.
Đúng 0
Bình luận (0)
Tính pH của cá dd sau :
a) 500 ml dd chứa 0,56 gam KOH
b) trộn 200 ml dd H2SO4 0,2 với 500 ml dd NaOH 0,118 M
a, Ta có: \(n_{KOH}=\frac{0,56}{56}=0,01\left(mol\right)\)
\(KOH\rightarrow K^++OH^-\)
0,01 __________ 0,01 (mol)
\(\Rightarrow\left[OH^-\right]=\frac{0,01}{0,5}=0,02M\)
\(\Rightarrow\left[H^+\right]=5.10^{-13}M\)
\(\Rightarrow pH=-log\left[H^+\right]\approx12,3\)
b, Ta có: \(n_{H^+}=2n_{H_2SO_4}=0,08\left(mol\right)\)
\(n_{OH^-}=n_{NaOH}=0,059\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
_____0,059 ← 0,059 (mol)
⇒ OH- dư. \(n_{OH^-\left(dư\right)}=0,021\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\frac{0,021}{0,7}=0,03M\)
\(\Rightarrow\left[H^+\right]\approx3,33.10^{-13}\)
\(\Rightarrow pH\approx12,5\)
Bạn tham khảo nhé!
Tính pH của cá dd sau :
a) 500 ml dd chứa 0,28 gam KOH
b) trộn 300 ml dd H2SO4 0,1 với 500 ml dd NaOH 0,1 M
a, Ta có: \(n_{KOH}=0,005\left(mol\right)\)
\(\Rightarrow n_{OH^-}=n_{KOH}=0,005\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\frac{0,005}{0,5}=0,01M\)
\(\Rightarrow\left[H^+\right]=10^{-12}M\Rightarrow pH=12\)
b, Ta có: \(n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(n_{OH^-}=n_{NaOH}=0,05\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,05 ← 0,05 (mol)
⇒ H+ dư. \(n_{H^+\left(dư\right)}=0,01\left(mol\right)\Rightarrow\left[H^+\right]=0,0125M\)
\(\Rightarrow pH=-log\left[H^+\right]\approx1,9\)
Bạn tham khảo nhé!




















