cho hấp thụ hoàn toàn 7.84 l khí SO2 vào 200 m dd Ca(OH)2 thì thu đc 41,05 g muối .Tính nồng độ của dd Ca(OH)2 đã dùng

Những câu hỏi liên quan
Để hấp thụ hoàn toàn 7,84l khí SO2 (đktc) thì cần vừa đủ 250ml dd Ca(OH)2 . Tính nồng độ dd Ca(OH)2 đã dùng.giải hộ
nSO2 = 7.84 / 22.4 = 0.35 (mol)
Ca(OH)2 + SO2 => CaSO3 + H2O
0.35............0.35
C M Ca(OH)2 = 0.35 / 0.25 = 1.4 (M)
Đúng 1
Bình luận (1)
để hấp thụ hoàn toàn 7,84 lít khi SO2(dktc) khi cần dùng 200 ml dd Ca(OH)2 1,4M
a) tính khối lượng muối khan thu được sau phản ứng
b) tính nồng độ mol dd thu đc sau phản ứng, biết thể tích dung dịch thay đổi không đáng kể
ai cứu em với :<
\(n_{SO_2}= \dfrac{7,84}{22,4}=0,35 mol\)
\(n_{Ca(OH)_2}= 0,2 . 1,4=0,28mol\)
Ta có:
\(T=\dfrac{n_{nhóm OH}}{n_{SO_2}}\)\(=\dfrac{2. 0,28}{0,35}= 1,6\)
Có: 1<T<2
Nên Phản ứng tạo hỗn hợp 2 muối trung hòa và axit
\(Ca(OH)_2 + SO_2 \rightarrow CaSO_3 + H_2O\) (1)
\(CaSO_3 + SO_2 + H_2O \rightarrow Ca(HSO_3)_2\) (2)
Theo PTHH (1):
\(n_{SO_2(1)}\)\(n_{CaSO_3} = n_{Ca(OH)_2}= 0,28mol\)
\(\Rightarrow n_{SO_2(2)}=0,35 - 0,28= 0,07 mol\)
Theo PTHH (2):
\(n_{CaSO_3bị hòa tan}\)\(=\)\(n_{Ca(HSO_3)_2}= n_{SO_2(2)}= 0,07 mol\)
Suy ra: \(n_{CaSO_3 sau pư}= 0,28 - 0,07= 0,21 mol\)
\(m_{muối}= m_{CaSO_3} + m_{Ca(HSO_3)_2}= 0,21 .120 + 0,07 . 202= 39,34g\)
b)
\(C_{M Ca(HSO_3)_2}= \dfrac{0,07}{0,2}= 0,35M\)
Đúng 1
Bình luận (3)
Tiếp của NaOH nhé:
PTHH:
SO2 + Ca(OH)2 ---> CaSO3 + H2O (1)
2SO2 + Ca(OH)2 ---> Ca(HSO3)2
a. Gọi x, y lần lượt là số mol của CaSO3 và Ca(HSO3)2
Theo PT(1): \(n_{SO_2}=n_{Ca\left(OH\right)_2}=n_{CaSO_3}=x\left(mol\right)\)
Theo PT(2): \(n_{SO_2}=2.n_{Ca\left(HSO_3\right)_2}=2y\left(mol\right)\)
Theo PT(2): \(n_{Ca\left(OH\right)_2}=n_{Ca\left(HSO_3\right)_2}=y\left(mol\right)\)
Vậy ta được:
\(\left\{{}\begin{matrix}x+2y=0,35\\x+y=0,28\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,21\\y=0,07\end{matrix}\right.\)
=> \(m_{CaSO_3}=0,21.120=25,2\left(g\right)\)
b. Ta có: \(V_{dd_{Ca\left(OH\right)_2}}=V_{dd_{thu.được}}=\dfrac{200}{1000}=0,2\left(mol\right)\)
\(C_{M_{Ca\left(HSO_3\right)_2}}=\dfrac{0,07}{0,2}=0,35M\)
Đúng 1
Bình luận (1)
Cho 2,24 lít khí
C
O
2
( đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch
C
a
(
O
H
)
2
chỉ thu được muối
C
a
C
O
3
. Nồng độ mol của dung dịch Ca(OH)2 cần dùng là A. 0,5M B. 0,25M C. 0,1M D. 0,05M
Đọc tiếp
Cho 2,24 lít khí C O 2 ( đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch C a ( O H ) 2 chỉ thu được muối C a C O 3 . Nồng độ mol của dung dịch Ca(OH)2 cần dùng là
A. 0,5M
B. 0,25M
C. 0,1M
D. 0,05M
Cho 2,24 lít khí C
O
2
( đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch Ca(OH
)
2
, chỉ thu được muối CaC
O
3
. Nồng độ mol của dung dịch Ca(OH
)
2
cần dùng là: A. 0,5M B. 0,25M C. 0,1M D. 0,05M
Đọc tiếp
Cho 2,24 lít khí C O 2 ( đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch Ca(OH ) 2 , chỉ thu được muối CaC O 3 . Nồng độ mol của dung dịch Ca(OH ) 2 cần dùng là:
A. 0,5M
B. 0,25M
C. 0,1M
D. 0,05M
Chọn A
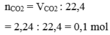
Theo bài ra ta có sau phản ứng chỉ thu được muối CaC O 3 do đó ta có phản ứng
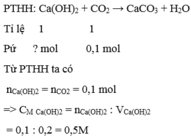
Đúng 0
Bình luận (0)
hấp thụ hòan tòan 280ml khí cacbonic (đktc) vào 750 gam dd Ca(OH)2 0,148%
1, tính số gam kết tủa thu đc
2, dd thu đc nặng hay nhẹ hơn dd Ca(OH)2 ban đầu
3, tính nồng độ % chất tan trong dd sau phản ứng
1)
n CO2 = 280/1000.22,4 = 0,0125(mol)
n Ca(OH)2 = 750.0,148%/74 = 0,015(mol)
Vì n CO2 / n Ca(OH)2 = 0,0125/0,015 = 0,83 < 1 nên Ca(OH)2 dư
CO2 + Ca(OH)2 → CaCO3 + H2O
n CaCO3 = n CO2 = 0,0125(mol)
=> m CaCO3 = 0,0125.100 = 1,25(gam)
2)
Ta có :
m CO2 - m CaCO3 = 0,0125.44 -1,25 = -0,7
Suy ra khối lượng dung dịch giảm 0,7 gam
3)
n Ca(OH)2 dư = 0,015 - 0,0125 = 0,0025(mol)
Sau phản ứng :
m dd = 0,0125.44 + 750 - 1,25 = 749,3(gam)
C% Ca(OH)2 = 0,0025.74/749,3 .100% = 0,025%
Đúng 2
Bình luận (0)
Tính nồng độ mol của các chất tan trong dd thu đc sau mỗi thí nghiệm sau đây. Biết các pư xảy ra hoàn toàn, V dd thay đổi k đáng kể.
a. Sục 448ml khí CO2 (đktc) vào 400ml dd Ca(OH)2 0,02M
b. Sục 4,032 lít khí SO2 (đktc) vào 200ml dd Ba(OH)2 1M
a. \(n_{CO_2}=0,02\left(mol\right);n_{Ca\left(OH\right)_2}=0,008\left(mol\right)\Rightarrow n_{OH^-}=0,016\\ Tacó:\dfrac{n_{OH^-}}{n_{CO_2}}=\dfrac{0,016}{0,02}=0,8\Rightarrow ChỉtạoCa\left(HCO_3\right)_2,CO_2dư\\ 2CO_2+Ca\left(OH\right)_2\rightarrow Ca\left(HCO_3\right)_2+H_2O\\ n_{Ca\left(HCO_3\right)_2}=n_{Ca\left(OH\right)_2}=0,016\left(mol\right)\\ \Rightarrow CM_{Ca\left(HCO_3\right)_2}=\dfrac{0,016}{0,4}=0,04M\)
Đúng 2
Bình luận (0)
\(b.n_{SO_2}=0,18\left(mol\right);n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\Rightarrow n_{OH^-}=0,4\left(mol\right)\\Tacó:\dfrac{n_{OH^-}}{n_{CO_2}}=\dfrac{0,4}{0,18}=2,22\Rightarrow Ba\left(OH\right) _2dư\\ SO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\\ n_{Ba\left(OH\right)_2dư}=0,2-0,18=0,02\left(mol\right)\\ \Rightarrow CM_{Ba\left(OH\right)_2dư}=\dfrac{0,02}{0,2}=0,1M\)
Đúng 2
Bình luận (0)
Hấp thụ hoàn toàn 3,36l co2 (dktc) vào 125 ml dd ca(oh)2 1m thu đc dd x coi thể tích dd k thay đổi ,nồng độ mol chất tan trong dd x là
Xem chi tiết
nCO2 = 3.36/22.4 = 0.15 (mol)
nCa(OH)2 = 0.125*1 = 0.125 (mol)
nCO2 / nCa(OH)2 = 0.15/0.125 = 1.2
=> Tạo ra 2 muối
Đặt :
nCaCO3 = x (mol)
nCa(HCO3)2 = y (mol)
BT Ca :
x + y = 0.125
BT C :
x + 2y = 0.15
=> x = 0.1
y = 0.025
C M Ca(HCO3)2 = 0.025/0.125 = 0.2 (M)
Đúng 2
Bình luận (0)
nCO2=0,15 mol, nBa(OH)2=0,125 mol
1<nOH-/nCO2=0,25/0,15=1,67<2 => Tạo 2 muối
BaCO3: x
Ba(HCO3)2: y
x+y=nBa2+=0,125
x+2y=nC=0,15
=>x=0,1; y=0,025
CM Ba(HCO3)2=0,025/0,125=0,2M
Đúng 0
Bình luận (2)
Bài 25: Nung nóng 40 g đá vôi (có chứa 80% CaCO3 ) đến khối lượng không đổi.
a/ Tính thể tích khí (đktc) thu được?
b/ Dùng dd Ca(OH)2 0,5% để hấp thu hoàn toàn lượng khí trên thu được muối trung hòa. Tính khối lượng dd Ca(OH)2 cần dùng?
a)\(CaCO_3-^{t^o}\rightarrow CaO+CO_2\)
\(n_{CaCO_3}=\dfrac{40.80\%}{100}=0,32\left(mol\right)\)
\(n_{CO_2}=n_{CaCO_3}=0,32\left(mol\right)\)
b) \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
\(n_{Ca\left(OH\right)_2}=n_{CO_2}=0,32\left(mol\right)\)
=> \(m_{ddCa\left(OH\right)_2}=\dfrac{0,32.74}{0,5\%}=4736\left(g\right)\)
Đúng 3
Bình luận (0)
Hấp thụ hoàn toàn 3,36l CO2 vào 125 ml Ba(oh)2 1M thì thu đc dd X. Tính nồng độ chất tan trg dd X
\(\dfrac{n_{OH^{^{ }-}}}{n_{CO_2}}=\dfrac{0,125.2}{\dfrac{3,36}{22,4}}=1,67\Rightarrow Tạo.2.muối\\ Ba\left(OH\right)_2+CO_2->BaCO_3+H_2O\\ BaCO_3+CO_2+H_2O->Ba\left(HCO_3\right)_2\\ n_{BaCO_3max}=0,125mol=n_{CO_2\left(1\right)}\\ n_{Ba\left(HCO_3\right)_2}=0,15-0,125=0,025mol\\ C_{M\left(Ba\left(HCO_3\right)_2\right)}=\dfrac{0,025}{0,125}=0,2M\)
Đúng 4
Bình luận (2)
Tham khảo:
nCO2=0,15 mol, nBa(OH)2=0,125 mol
1<nOH-/nCO2=0,25/0,15=1,67<2 => Tạo 2 muối
BaCO3: x
Ba(HCO3)2: y
x+y=nBa2+=0,125
x+2y=nC=0,15
=>x=0,1; y=0,025
CM Ba(HCO3)2=0,025/0,125=0,2M
Đúng 2
Bình luận (0)
\(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,125\cdot1=0,125\left(mol\right)\)
\(T=\dfrac{n_{Ba\left(OH\right)_2}}{n_{CO_2}}=\dfrac{0,125}{0,15}=\dfrac{5}{6}\Rightarrow\dfrac{1}{2}< T< 1\)
⇒ Phản ứng tạo ra 2 muối \(Ba\left(HCO_3\right)_2\) và \(BaCO_3\downarrow\).
Gọi số mol \(\left\{{}\begin{matrix}Ba\left(HCO_3\right)_2:x\\BaCO_3:y\end{matrix}\right.\left(mol\right).ĐK:x;y>0\)
PTPƯ:
\(Ba\left(OH\right)_2+2CO_2\rightarrow Ba\left(HCO_3\right)_2\)
x ← 2x ← x
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
y ← y ← y
Ta có hpt:
\(\left\{{}\begin{matrix}2x+y=0,15\\x+y=0,125\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,025\\y=0,1\end{matrix}\right.\)
Nồng độ chất tan:
\(C_M\left[\left(BaHCO_3\right)_2\right]=\dfrac{0,025}{0,125}=0,2\left(M\right)\)
Đúng 1
Bình luận (2)




























