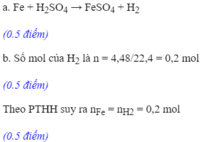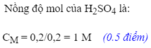Tính khối lượng axit H2SO4 cần dùng để khi cho vào 380g H20 thì được dung dịch axit có nồng độ 5%

Những câu hỏi liên quan
Bài 1: Cần thêm bao nhiêu gam SO3 vào dung dịch H2SO4 nồng độ 10% để được 100 gam H2SO4 phải thêm nước vào dung dịch H2SO4 50% để thu được dung dịch H2SO4 20%. Tính tỉ lệ về khối lượng nước và dung dịch axit phải dùng để thu được dung dịch 20%.
Hoà tan 5,6 g sắt bằng dung dịch axit H2SO4 nồng độ 10% vừa đủ.
a. Tính thể tích hiđro thoát ra ở đktc.
b. Tính khối lượng muối thu được sau phản ứng.
c. Tính khối lượng dung dịch axit H2SO4 cần dùng.
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2|\)
1 1 1 1
0,1 0,1 0,1 0,1
a) \(n_{H2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
b) \(n_{FeSO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{FeSO4}=0,1.152=15,2\left(g\right)\)
c) \(n_{H2SO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(m_{H2SO4}=0,1.98=9,8\left(g\right)\)
\(m_{ddH2SO4}=\dfrac{9,8.100}{10}=98\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
khi hòa tan H2So4 nhôm vào 200mml dung dịch người ta thấy 2,24 lít khí H2 thoát ra (đktc)
a) tính khối lượng muối thu được sau phản ứng
b) tính nồng độ mol của Axit H2So4 cần dùng
2Al+3H2SO4->Al2(SO4)3+3H2
0,1----------\(\dfrac{1}{30}\)-------0,1 mol
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
=>m Al2(SO4)3=\(\dfrac{1}{30}\).342=11,4g
=>CM H2SO4=\(\dfrac{0,1}{0,2}\)=0,5 M
Đúng 3
Bình luận (2)
Cho 2,24 lít khí SO3 (đktc) hòa tan vào nước thu được 500ml dung dịch axit sunfuric(H2SO4)
a) Tính nồng độ mol của dung dịch axit H2SO4.
b)Tính khối lượng Zn có thể phản ứng hết với axit có trong dung dịch trên?
a, PTPƯ: SO3 + H2O ---> H2SO4
nSO3=\(\dfrac{2,24}{22,4}=0,1mol\)
1 mol SO3 ---> 0,1 mol H2SO4
nên 0,1 mol SO3 ---> 0,1 mol H2SO4
CM H2SO4=\(\dfrac{0,1}{0,5}\)=0,2 M
b, PTPƯ: Zn + H2SO4 ---> ZnSO4 + H2
1 mol H2SO4 ---> 1 mol Zn
nên 0,1 mol H2SO4 ---> 0,1 mol Zn
mZn=0,1.65=6,5 g
Đúng 1
Bình luận (0)
Cho 200 gam dung dịch NaOH 4% tác dụng vừa đủ với dung dịch axit H2SO4 0,2M. a) Tính thể tích dung dịch axit cần dùng ? b) Biết khối lượng của dung dịch axit trên là 510 gam. Tính nồng độ % của chất có trong dung dịch sau phản ứng?
\(n_{NaOH}=\dfrac{200\cdot4\%}{40}=0.2\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(0.2..............0.1..............0.1\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.1}{0.2}=0.5\left(l\right)\)
\(m_{Na_2SO_4}=0.1\cdot142=14.2\left(g\right)\)
\(m_{dd}=200+510=710\left(g\right)\)
\(C\%_{Na_2SO_4}=\dfrac{14.2}{710}\cdot100\%=2\%\)
Đúng 2
Bình luận (1)
Ta có: mNaOH = 200.4% = 8 (g)
\(\Rightarrow n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
PT: \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
_____0,2______0,1_______0,1 (mol)
a, \(V_{ddH_2SO_4}=\dfrac{0,1}{0,2}=0,5\left(l\right)\)
b, Chất có trong dd sau pư là Na2SO4.
Ta có: m dd sau pư = m dd NaOH + m dd H2SO4 = 200 + 510 = 710 (g)
\(\Rightarrow C\%_{Na_2SO_4}=\dfrac{0,1.142}{710}.100\%=2\%\)
Bạn tham khảo nhé!
Đúng 0
Bình luận (0)
\(m_{NaOH}=\dfrac{200.4}{100}=8\left(g\right)\\ n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(PTHH:2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
a) \(n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
\(V_{ddH_2SO_4}=\dfrac{n_{H_2SO_4}}{C_{M_{ddH_2SO_4}}}=\dfrac{0,1}{0,2}=0,5\left(l\right)=500\left(ml\right)\)
b) \(n_{Na_2SO_4}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(m_{Na_2SO_4}=0,1.142=14,2\left(g\right)\)
\(m_{\text{dd sau pư}}=m_{ddNaOH}+m_{ddH_2SO_4}=200+510=710\left(g\right)\)
\(C\%_{Na_2SO_4}=\dfrac{m_{Na_2SO_4}}{m_{\text{dd sau pư}}}.100\%=\dfrac{14,2}{710}.100\%=2\%\)
Đúng 0
Bình luận (0)
Tính m gam BaCl2.2H2O cần thêm 100ml axit H2SO4 có nồng độ 40% (d=1,3g/ml).Để được dung dịch có phần khối lượng của H2SO4 20%
Trong phòng thí nghiệm,bạn An pha được 196g dung dịch axit H2SO4 có nồng độ 20%
a/Tính lượng chất tan H2SO4 có trong dung dịch trênb/Tính lượng nước đã dùng để pha loãng axit trên\(n_{H_2SO_4}=\dfrac{196.20\%}{98}=0,4\left(mol\right)\\ a,m_{H_2SO_4}=0,4.98=39,2\left(g\right)\\ b,m_{H_2O}=196-39,2=156,8\left(g\right)\)
Đúng 3
Bình luận (0)
Cho một lượng bột sắt dư vào 200ml dung dịch axit H 2 S O 4 . Phản ứng xong thu được 4,48 lít khí hiđrô (đktc)
a. Viết phương trình phản ứng hoá học
b. Tính khối lượng sắt đã tham gia phản ứng
c. Tính nồng độ mol của dung dịch axit H 2 S O 4 đã dùng
Cho 24g SO3 tan hoàn toàn vào nước thu được 500ml dung dịch axit H2SO4
a,viết PTHH
b,tính nồng độ mol của dung dịch
c,tính khối lượng nhôm đủ để phản ứng hết với lượng axit có trong dung dịch
Đổi 500 ml = 0,5 (l)
Số mol SO3 là: 24 : 80 = 0,3 (mol)
SO3 + H2O = H2SO4
0,3 0,3 (mol)
Nồng độ mol dung dịch là : 0,3 : 0,5 = 0,6 (M)
Al + H2SO4 = Al2(SO4)3 + H2
0,3 0,3 (mol)
Khối lượng Al cần tìm là: 27 x 0,3 = 8,1 (g)
Đúng 0
Bình luận (0)