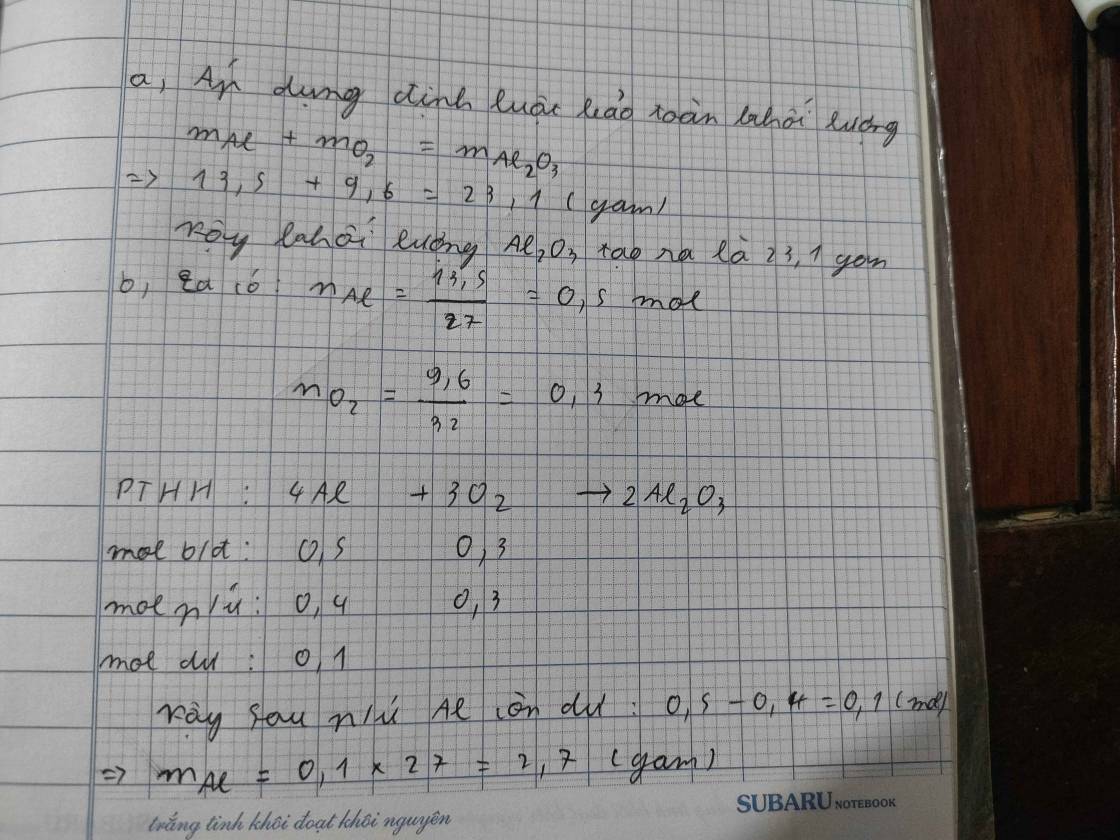cho 5,4(g) Al tác dụng với 6,4(g) O2. Tính khối lượng các chất sau phản ứng

Những câu hỏi liên quan
cho 5,4(g) Al tác dụng với 6,4(g) O2. Tính khối lượng các chất sau p
Cho 5,4 gam Al tác dụng với 25,55 g HCL thu được muối nhôm tạo ra và giai phong khí hidro a)Viết phương trình phản ứng b)chất nào dư sau phản ứng?Tính khối lượng các chất sau phản ứng
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{HCl}=\dfrac{25,55}{36,5}=0,7\left(mol\right)\\a. 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ b.Vì:\dfrac{0,2}{2}< \dfrac{0,7}{6}\\ \Rightarrow HCldư\\ n_{HCl\left(dư\right)}=0,7-\dfrac{6}{2}.0,2=0,1\left(mol\right)\\ n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ m_{H_2}=0,3.2=0,6\left(g\right)\\ m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\\ m_{AlCl_3}=133,5.0,2=26,7\left(g\right)\)
Đúng 3
Bình luận (0)
Cho 13,5 g Al tác dụng với 9,6 g O2, tạo ra Al2O3.
a) Tính khối lượng Al2O3 tạo ra
b) Sau phản ứng dư chất nào, tính khối lượng chất dư đó?
5,4 g Al tác dụng với O2 .Viết phương trình phản ứng .Tính khối lượng sản phẩm.
11,2 g Fe tác dụng với không khí( điều kiện chuẩn )tạo sắt từ oxit .Viết phương trình phản ứng tính thể tích của không khí (điều kiện chuẩn), khối lượng sản phẩm. Tính m Fe và O2 cần
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
Ta có :
\(n_{Al_2O_3}=\dfrac{0.2\cdot2}{4}=0.1\left(mol\right)\)
\(m_{Al_2O_3}=0.1\cdot102=10.2\left(g\right)\)
Đúng 3
Bình luận (0)
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
\(0.2.......\dfrac{2}{15}.....\dfrac{1}{15}\)
\(V_{O_2}=\dfrac{2}{15}\cdot22.4=2.98\left(l\right)\)
\(m_{Fe_3O_4}=\dfrac{1}{15}\cdot232=15.46\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 6,5g kẽm tác dụng với 6,4 g lưu huỳnh theo sơ đồ:
Zn + S ---> ZnS
a/ Chất nào còn thừa sau phản ứng? khối lượng bao nhiêu?
b/ Tính khối lượng các chất còn lại sau phản ứng.
A) nZn=0,1(mol); nS=0,2(mol)
PTHH: Zn + S -to-> ZnS
Ta có: 0,2/1 > 0,1/1
=> Zn hết, S dư, tính theo nZnS
=> nZnS= nS(p.ứ)=nZn=0,1(mol)
=> nS(dư)=0,2-0,1=0,1(mol)
=>mS(dư)=0,1.32=3,2(g)
b) mZnS=0,1.81=8,1(g)
Đúng 0
Bình luận (0)
Câu 11. Cho 11,2 g CaO tác dụng với dung dịch có chứa 39,2 g H2SO4. Tính khối lượng các chất còn lại trong phản ứng hóa học trên (không tính khối lượng nước)Câu 12. Đốt cháy 6,4 g lưu huỳnh bằng 11,2 lít khí O2 (đktc) thu được sản phẩm là SO2. Tính thể tích của các khí thu được sau phản ứng hóa học trên ở đktcCâu 13. Đốt cháy 4,8 g cacbon bằng 6,72 lít khí oxi thu được sản phẩm sau phản ứng là CO2. Tìm khối lượng chất còn dư và thể tích khí CO2 thu đượcCâu 14. Cho 20,8 g BaCl2 tác dụng với dung...
Đọc tiếp
Câu 11. Cho 11,2 g CaO tác dụng với dung dịch có chứa 39,2 g H2SO4. Tính khối lượng các chất còn lại trong phản ứng hóa học trên (không tính khối lượng nước)
Câu 12. Đốt cháy 6,4 g lưu huỳnh bằng 11,2 lít khí O2 (đktc) thu được sản phẩm là SO2. Tính thể tích của các khí thu được sau phản ứng hóa học trên ở đktc
Câu 13. Đốt cháy 4,8 g cacbon bằng 6,72 lít khí oxi thu được sản phẩm sau phản ứng là CO2. Tìm khối lượng chất còn dư và thể tích khí CO2 thu được
Câu 14. Cho 20,8 g BaCl2 tác dụng với dung dịch chứa 9,8 g H2SO4. Tính khối lượng các chất thu được sau phản ứng.
Câu 15. Cho 20 g CuO tác dụng với dung dịch chứa 18,25 g HCl. Tính khối lượng các chất thu được sau phản ứng.
Câu 11:
\(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right);n_{H_2SO_4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
PTHH: \(CaO+H_2SO_4\rightarrow CaSO_4+H_2O\)
Ban đầu: 0,2 0,4 0,2
Sau pư: 0 0,2 0,2
`=>`\(\left\{{}\begin{matrix}m_{H_2SO_4}=0,2.98=19,6\left(g\right)\\m_{CaSO_4}=0,2.136=27,2\left(g\right)\end{matrix}\right.\)
Câu 12:
\(n_S=\dfrac{6,4}{32}=0,2\left(mol\right);n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: \(S+O_2\xrightarrow[]{t^o}SO_2\)
Ban đầu: 0,2 0,5
Sau pư: 0 0,3 0,2
`=>`\(\left\{{}\begin{matrix}V_{O_2}=0,3.22,4=6,72\left(l\right)\\V_{SO_2}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
Câu 13:
\(n_C=\dfrac{4,8}{12}=0,4\left(mol\right);n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
Ban đầu: 0,4 0,3
Sau pư: 0,1 0 0,3
`=>`\(\left\{{}\begin{matrix}m_{C\left(d\text{ư}\right)}=0,1.12=1,2\left(g\right)\\V_{CO_2}=0,3.22,4=6,72\left(l\right)\end{matrix}\right.\)
Câu 14:
\(n_{BaCl_2}=\dfrac{20,8}{208}=0,1\left(mol\right);n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Ban đầu: 0,1 0,1
Sau pư: 0 0 0,1 0,2
`=>`\(\left\{{}\begin{matrix}m_{BaSO_4}=0,1.233=23,3\left(g\right)\\m_{HCl}=0,2.36,5=7,3\left(g\right)\end{matrix}\right.\)
Câu 15:
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right);n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
Ban đầu: 0,25 0,5
Sau pư: 0 0 0,25
`=>`\(m_{CuCl_2}=0,25.135=33,75\left(g\right)\)
Đúng 2
Bình luận (0)
Đốt cháy 6,4 gam lưu huỳnh trong khí 02 tạo thành khí SO2 a) tính thể tích o2 ai b) tính ms02 c) cho khối lượng o2 ở trên tác dụng với 0,2 g khí hidro tính khối lượng nước tạo thành sau phản ứng
a.b.\(n_S=\dfrac{m_S}{M_S}=\dfrac{6,4}{32}=0,2mol\)
\(S+O_2\rightarrow SO_2\)
0,2 0,2 0,2 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,2.22,4=4,48l\)
\(m_{SO_2}=n_{SO_2}.M_{SO_2}=0,2.64=12,8g\)
c.\(n_{H_2}=\dfrac{m_{H_2}}{M_{H_2}}=\dfrac{0,2}{2}=0,1mol\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,1 < 0,2 ( mol )
0,1 0,1 ( mol )
\(m_{H_2O}=n_{H_2O}.M_{H_2O}=0,1.18=1,8g\)
Đúng 2
Bình luận (2)
Cho 5,4 g Al phản ứng hoàn toàn với 34,3 g dd H2SO4
a. Viết pthh
b. Cho lương H2 tạo thành phản ứng với 12 g đồng II oxide. Tính khối lượng chất rắn thu được sau pứ
nếu là 34,3 g dung dịch H2SO4 thì đề thiếu C% á :v
Đúng 0
Bình luận (0)
cho S,P,N2,C,Al Viết phương trình phản ứng với O2 cho Al tác dụng với 3,2 (g) O2 sinh ra 10,2 g một chất .tính mal T/G phản ứng
\(S+O_2\rightarrow\left(t^o\right)SO_2\\ 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\2 N_2+5O_2\rightarrow\left(3000^oC\right)2N_2O_5\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ ----\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right);n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\\ Vì:\dfrac{0,1}{3}< \dfrac{0,1}{2}\Rightarrow Xem.lại.đề\)
Đúng 0
Bình luận (0)