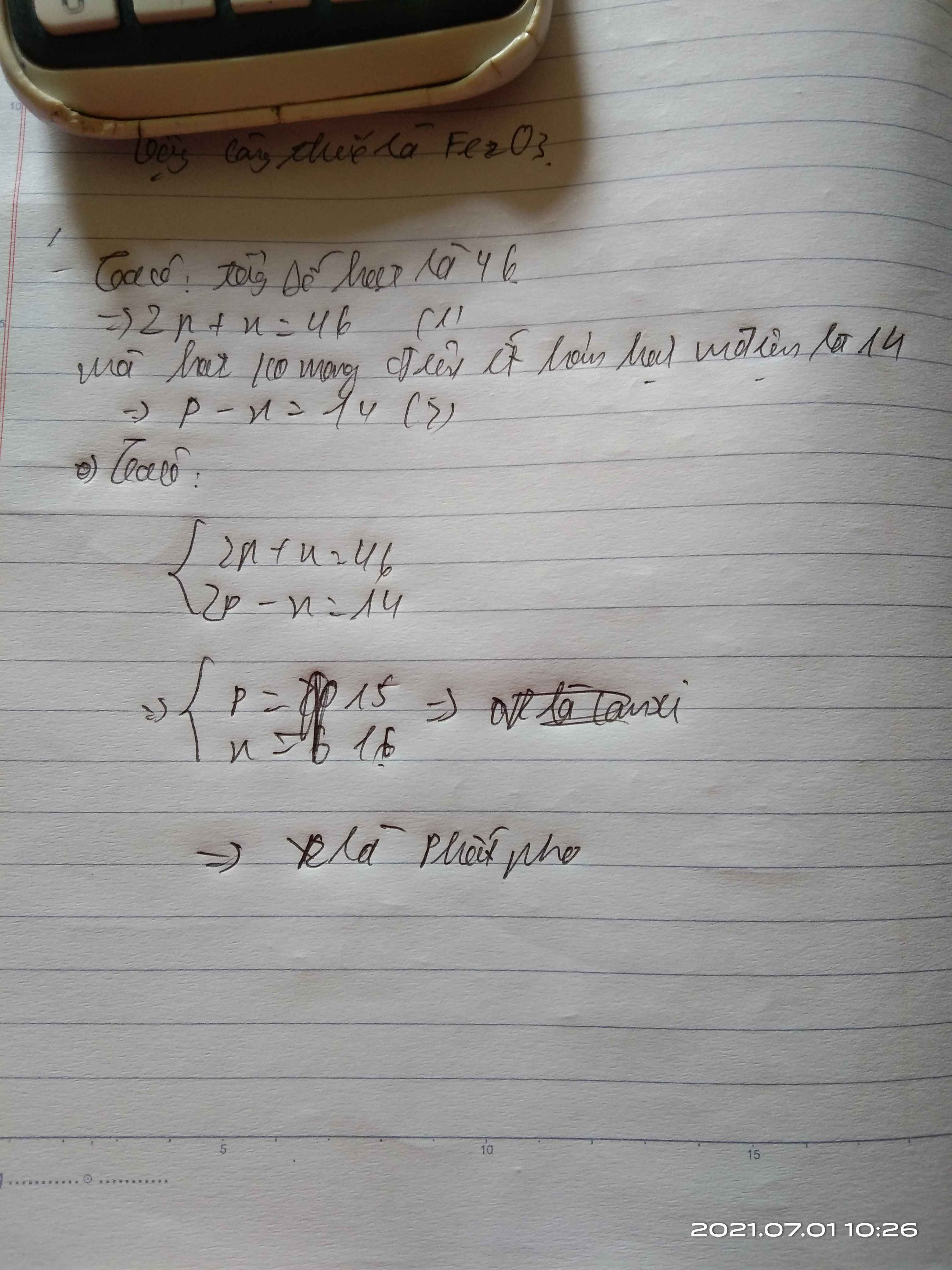Tổng số hạt cơ bản là 46, số hạt mang điện nhiều hơn số hạt không mang điện là 14 hạt.

Những câu hỏi liên quan
Tổng số hạt cơ bản là 46, số hạt mang điện dương ít hơn số hạt không mang điện là 1.a) Tổng số hạt cơ bản là 82, số hạt mang điện bằng 26/15 số hạt không mang điệnb) Tổng số hạt cơ bản là 40, số hạt không mang điện ít hơn số hạt có mang điện là 12 hạtc) Tổng số hạt cơ bản là 95, số hạt ở vỏ nguyên tử ít hơn số hạt trong hạt nhân là 35 hạtd) Số hạt ở hạt nhân là 35 và số hạt mang điện âm bằng 32,692 tổng số hạt
Đọc tiếp
Tổng số hạt cơ bản là 46, số hạt mang điện dương ít hơn số hạt không mang điện là 1.a) Tổng số hạt cơ bản là 82, số hạt mang điện bằng 26/15 số hạt không mang điệnb) Tổng số hạt cơ bản là 40, số hạt không mang điện ít hơn số hạt có mang điện là 12 hạtc) Tổng số hạt cơ bản là 95, số hạt ở vỏ nguyên tử ít hơn số hạt trong hạt nhân là 35 hạtd) Số hạt ở hạt nhân là 35 và số hạt mang điện âm bằng 32,692 tổng số hạt
a. Tổng số hạt cơ bản của nguyên tử nguyên tố X là 155, số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt.a. Tổng số hạt cơ bản của nguyên tử nguyên tố X là 46, số hạt không mang điện bằng 8/15 số hạt mang điện.b. Nguyên tử titan (Ti) có tổng số hạt (p, n, e) là 70 ạthạt, trong đó hạt mang điện dương ít hơn hhhhhdsdfzhxfmhhj athạt không mang điện 4 hạt.
Đọc tiếp
a. Tổng số hạt cơ bản của nguyên tử nguyên tố X là 155, số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt.
a. Tổng số hạt cơ bản của nguyên tử nguyên tố X là 46, số hạt không mang điện bằng 8/15 số hạt mang điện.
b. Nguyên tử titan (Ti) có tổng số hạt (p, n, e) là 70 ạthạt, trong đó hạt mang điện dương ít hơn hhhhhdsdfzhxfmhhj athạt không mang điện 4 hạt.
c. Tổng số hạt cơ bản là 40, số hạt không mang điện nhiều hơn số hạt mang điện dương là 1 hạt.d. Tổng số hạt cơ bản là 36, số hạt mang điện gấp đôi số hạt không mang điện.e. Tổng số hạt cơ bản là 52, số hạt không mang điện bằng 1,06 lần số hạt mang điện âm.f. Tổng số hạt cơ bản là 49, số hạt không mang điện bằng 53,125% số hạt mang điện.g. Tổng số hạt trong nguyên tử là 34, số hạt trong nhân nhiều hơn số hạt ngoài vỏ là 12 hạt.
Đọc tiếp
c. Tổng số hạt cơ bản là 40, số hạt không mang điện nhiều hơn số hạt mang điện dương là 1 hạt.
d. Tổng số hạt cơ bản là 36, số hạt mang điện gấp đôi số hạt không mang điện.
e. Tổng số hạt cơ bản là 52, số hạt không mang điện bằng 1,06 lần số hạt mang điện âm.
f. Tổng số hạt cơ bản là 49, số hạt không mang điện bằng 53,125% số hạt mang điện.
g. Tổng số hạt trong nguyên tử là 34, số hạt trong nhân nhiều hơn số hạt ngoài vỏ là 12 hạt.
nbbnbnv ghvghgggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggggg
Nguyên tử R có tổng số hạt cơ bản là 46.Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14.Xác định tên của nguyên tố R.
Đang cần gấp
Tổng số hạt là 46
\(\Rightarrow p+n+e=46\)
\(\Leftrightarrow2p+n=46\left(p=e\right)\left(1\right)\)
Số hạt mang điện nhiều hơn hạt k mang điện là 14
\(\Rightarrow2p-n=14\left(2\right)\)
Từ 1 và 2 suy ra
\(\left\{{}\begin{matrix}p=e=15\\n=16\end{matrix}\right.\)
=> R là phốt pho
Đúng 2
Bình luận (2)
Ta có: p+e+n=46
mà (p+e)-n=14
=>2(p+e)=60
=>p+e=30
Mà trong 1 nguyên tử số p = số e
=>p=e=30:2=15
Vậy R là nguyên tử P(photpho)
Đúng 1
Bình luận (0)
Hợp chất M2X có tổng số hạt cơ bản là 164, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 52. Tổng số hạt cơ bản của M nhiều hơn tổng số hạt cơ bản của X là 10 hạt. Số hạt mang điện trong hạt nhân nguyên tử X ít hơn số hạt mang điện của nguyên tử M là 22 hạt. Tìm M và X.
Theo đề bài ta có hệ PT sau :
\(\left\{{}\begin{matrix}2\left(2Z_M+N_M\right)+2Z_X+N_X=164\\4Z_M+2Z_X-\left(2N_M+N_X\right)=52\\\left(2Z_M+N_M\right)-\left(2Z_X+N_X\right)=10\\2Z_M-Z_X=22\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}Z_M=19\\N_M=20\\Z_X=16\\N_X=16\end{matrix}\right.\)
=>Vì ZM=19 nên M là Kali , ZX = 16 nên X là S
=> Hợp chất : K2S
Đúng 2
Bình luận (0)
a. Tổng số hạt cơ bản của nguyên tử nguyên tố X là 52, số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt.
b. Tổng số hạt cơ bản của nguyên tử nguyên tố X là 95, số hạt không mang điện ít hơn số hạt mang điện là 25 hạt.
a) \(\left\{{}\begin{matrix}2Z+N=52\\2Z-N=16\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}Z=17\\N=18\end{matrix}\right.\)
b) \(\left\{{}\begin{matrix}2Z+N=95\\2Z-N=25\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}Z=30\\N=35\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Tìm số P,E,N và viết kí hiệu nguyên tử trong các trường hợp sau:
a) Tổng số hạt cơ bản là 40, số hạt không mang điện nhiều hơn số hạt mang điện dương là 1
b) Tổng số hạt cơ bản là 36, số hạt mang điện gấp đôi số hạt không mang điện.
c) Tổng số hạt cơ bản là 52, số hạt không mang điện 1,06 lần số hạt mang điện âm
d) Tổng số hạt cơ bản là 49, số hạt không mang điện53,125% số hạt mang điện
Đọc tiếp
Tìm số P,E,N và viết kí hiệu nguyên tử trong các trường hợp sau: a) Tổng số hạt cơ bản là 40, số hạt không mang điện nhiều hơn số hạt mang điện dương là 1 b) Tổng số hạt cơ bản là 36, số hạt mang điện gấp đôi số hạt không mang điện. c) Tổng số hạt cơ bản là 52, số hạt không mang điện = 1,06 lần số hạt mang điện âm d) Tổng số hạt cơ bản là 49, số hạt không mang điện=53,125% số hạt mang điện
Cho nguyên tử Clo có tổng số hạt là 54 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14 . Tìm các hạt cơ bản
E, P, N tương ứng là tổng số hạt electron, proton và notron.
Vì E = P = Z nên: 2Z + N = 54 (1).
Số hạt mang điện nhiều hơn số hạt không mang điện là 14 nên: 2Z - N = 14 (2)
Giải hệ (1) và (2): Z = 17 = E = P và N = 20
Đúng 0
Bình luận (0)
Bài 1. Phân tử M3X2 có tổng số hạt cơ bản là 222, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 74. Tổng số hạt mang điện trong M2+ nhiều hơn tổng số hạt mang điện trong X3- là 21. Tính ZM, ZX