Trình bày phương pháp điều chế khí oxi trong phòng thí nghiệm và trong công nghiệp.

Những câu hỏi liên quan
Hãy trình bày các phương pháp điều chế khí oxi trong phòng thí nghiệm và trong công nghiệp. Tại sao không áp dụng phương pháp điều chế khí trong phòng thí nghiệm, và ngược lại?
Điều chế oxi:
- Trong phòng thí nghiệm, oxi được điều chế bằng cách phân hủy những hợp chất giàu Oxi và ít bên với nhiệt như KMnO4, KClO3, ...
2KMnO4 → K2MnO4 + MnO2 + O2
2KClO3 → 2KCl + 3O2
- Trong công nghiệp:
a) Từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, khí CO2, được hóa lỏng dưới áp suất 200 atm đồng thời hạ thấp nhiệt độ. Chưng cất phân đoạn không khí lỏng, thu được oxi lỏng. Oxi lỏng được vận chuyển trong những bình thép có thể tích 100 lít dưới áp suất 150atm.
b) Từ nước. Điện phân nước: 2H2O
Người ta không áp dụng phương pháp phòng thí nghiệm cho phòng thí nghiệm vì trong phòng thí nghiệm chỉ điều chế lượng nhỏ oxi, còn công nghiệp cần một lượng lớn giá thảnh rẻ.
Đúng 0
Bình luận (0)
1. Trình bày phương pháp điều chế oxi trong phòng thí nghiệm từ KMno4.
2. Trình bày phương pháp điều chế hiđro trong phòng thí nghiệm từ Zn và dung dịch HCl.
3. Có mấy cách thu khí hiđro và oxi? Giải thích.
1. Đốt nóng KMnO4 ở t độ cao:
\(2KMnO_4\rightarrow^{t^0}K_2MnO_4+MnO_2+O_2\uparrow\)
2. Cho Zn vào đ HCl thu được:
\(Zn+HCl\rightarrow ZnCl_2+H_2\uparrow\)
3. Thu O2: đẩy kk hoặc đẩy nước (Xem SGK)
Thu H2: đẩy nước hoặc đẩy kk (Xem SGK)
Đúng 0
Bình luận (0)
1 , nhiệt phân \(KMnO_4\)
\(2KMnO_4-t^o->K_2MnO_4+MnO_2+O_2\)
Đúng 0
Bình luận (0)
Hãy trình bày các phương pháp điều chế oxi trong phòng thí nghiệm và trong công nghiệp. Tại sao không áp dụng phương pháp điều chế oxi trong phòng thí nghiệm cho công nghiệp và ngược lại ?
Điều chế oxi:
- Trong phòng thí nghiệm, oxi được điều chế bằng cách phân hủy những hợp chất giàu Oxi và ít bên với nhiệt như KMnO4, KClO3, ...
2KMnO4 → K2MnO4 + MnO2 + O2
2KClO3 → 2KCl + 3O2
- Trong công nghiệp:
a) Từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, khí CO2, được hóa lỏng dưới áp suất 200 atm đồng thời hạ thấp nhiệt độ. Chưng cất phân đoạn không khí lỏng, thu được oxi lỏng. Oxi lỏng được vận chuyển trong những bình thép có thể tích 100 lít dưới áp suất 150atm.
b) Từ nước. Điện phân nước: 2H2O
Người ta không áp dụng phương pháp phòng thí nghiệm cho phòng thí nghiệm vì trong phòng thí nghiệm chỉ điều chế lượng nhỏ oxi, còn công nghiệp cần một lượng lớn giá thảnh rẻ.
Đúng 0
Bình luận (0)
Trình bày sự khác nhau về việc điều chế khí oxi trong phòng thí nghiệm và trong công nghiệp về nguyên liệu ,sản lượng và giá thành.
| Phòng thí nghiệm | Công nghiệp | |
| Nguyên liệu | Chất giàu Oxi như : KMnO4 . KClO3 | Không khí , nước |
| Sản lượng | Đủ dùng | sản lượng lớn |
| Giá thành | Cao | Thấp |
Đúng 1
Bình luận (0)
tại sao không áp dụng phương pháp điều chế khí oxi trong phòng thí nghiệm cho công nghiệp và ngược lại ?
Người ta không áp dụng phương pháp trong phòng thí nghiệm cho công nghiệp và ngược lại vì trong phòng thí nghiệm chỉ cần lượng nhỏ oxi, còn trong công nghiệp cần một lượng lớn, giá thành rẻ.
Đúng 0
Bình luận (0)
Bài 2 ( SGK - 94 ) : Trình bày sự khác nhau về việc điều chế khí oxi trong phòng thí nghiệm và trong công nghiệp về nguyên liệu ,sản lượng và giá thành.
Sự khác nhau về cách điều chế oxi trong phòng thí nghiệm (PTN) và trong công nghiệp (CN).
- Nguyên liệu:
PTN: KClO3 hoặc KMnO4(chất giàu oxi, phản ứng thực hiện nhanh, dễ dàng)
CN: Không khí và nước.
- Sản lượng:
PTN: Thể tích nhỏ dùng cho thí nghiệm.
CN: Sản lượng lớn dùng cho công nghiệp và y tế.
- Giá thành:
PTN: Giá thành cao.
CN: Giá thành hạ vì nguyên liệu là không khí và nước.
Cách điều chế trong CN và PTN cũng khác nhau, trong PTN nhiệt phân KClO3 (hoặc KMnO4) còn trong CN từ hóa lỏng không khí hay điện phân nước.
Đúng 1
Bình luận (0)
trình bày phương pháp hoá học nhận biết khí oxi cách điều chế khí oxi trong phòng thí nhiệm
refer
Điều chế, sản xuất Oxi (O2) trong phòng thí nghiệm và trong công nghiệp - hoá 8 bài 27
bấm vào ^
Đúng 1
Bình luận (1)
nhận biết khí Oxi bằng cách cho que đóm đang cháy vào lọ chứa khí Oxi
chúng sẽ cháy to
điều chế oxi bằng cách phân hủy cách chất giàu oxi và dễ phân hủy
điều chế Oxi bằng 2 phương pháp : đẩy nước và đẩy không khí
lưu ý : khi đẩy không khí ta phải để bình đựng khí ở trạng thái ngửa vì Oxi nặng hơn không khí
Đúng 0
Bình luận (0)
II-Tự luận
Viết phương trình điều chế: C l 2 trong công nghiệp và HCl trong phòng thí nghiệm (theo phương pháp sunfat)
- Sản xuất clo trong CN:
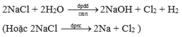
- Điều chế HCl trong PTN theo pp sunfat:
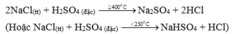
Đúng 0
Bình luận (0)
1. Phương pháp điều chế oxi trong phòng thí nghiệm làA. điện phân dung dịch hợp chất ít oxi. B. điện phân nước.C. chưng cất phân đoạn không khí lỏng. D. phân hủy hợp chất giàu oxi và ít bền với nhiệt2. Trong công nghiệp O2 được điều chế từA. nhiệt phân KMnO4. B. nhiệt phân KClO3.C. nhiệt phân HgO. D. chưng cất phân đoạn không khí lỏng
Đọc tiếp
1. Phương pháp điều chế oxi trong phòng thí nghiệm là
A. điện phân dung dịch hợp chất ít oxi.
B. điện phân nước.
C. chưng cất phân đoạn không khí lỏng.
D. phân hủy hợp chất giàu oxi và ít bền với nhiệt
2. Trong công nghiệp O2 được điều chế từ
A. nhiệt phân KMnO4.
B. nhiệt phân KClO3.
C. nhiệt phân HgO.
D. chưng cất phân đoạn không khí lỏng
Tính chất vật lí tính chất hóa học điều chế khí oxi trong phòng thí nghiệm và trong công nghiệp
























