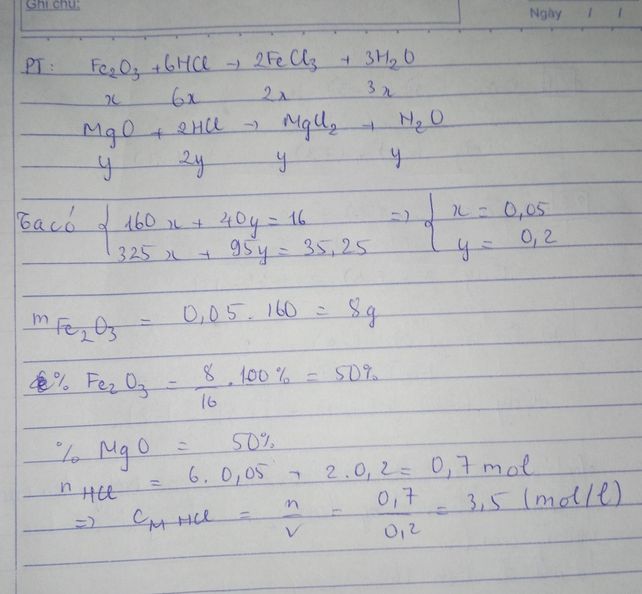Bài 1: hòa tan cho 10,5gam h/h bột gồm Mg, Fe tác dụng vs dd HCL dư có 0,4gam khí thoát ra tính k/lượng muối thu đc sau phản ứng
Bài 2: hòa tan 12,8gam hỗn hợp gồm Fe , FeO bằng dd HCL vừa đủ thu đc 2,24lit khí (ĐKTC). Tính phần trăm theo khối lượng của FeO trong hỗn hợp
Bài 3: khi cho 100ml dd KOH 1M và ml dd HCl thì phản ứng xảy ra vừa đủ. Tính nồng độ mol dd HCl đã dùng