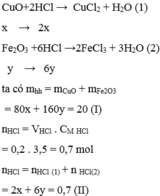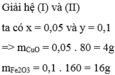hòa tan 20 g hỗn hợp gồm CuO và Fe2O3 cần 200ml dung dịch HCl 3,5M
a, tính khối lượng mỗi oxit
b, tính Cm của dung dịch sau phản ứng
hòa tan 20 g hỗn hợp gồm CuO và Fe2O3 cần 200ml dung dịch HCl 3,5M
a, tính khối lượng mỗi oxit
b, tính Cm của dung dịch sau phản ứng
Gọi a là số mol của CuO và b là số mol của Fe2O3 có trong 20 gam hh
200 ml dd HCl 3,5 M => 0,7 mol HCl
CuO + 2HCl ---> CuCl2 + H2o
a mol -->2a mol
Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O
b mol ----->6b mol
Ta có hệ PT:
80a + 160b = 20
2a + 6b = 0,7
Giải hệ trên ta được
a = 0,05 mol
b = 0,1 mol
=> khối lượng CuO trong hỗn hợp là 4 gam
=> %CuO = 20%
=> %Fe2O3 = 80%
200(ml) dung dịch HCL có nồng độ 3,5M hòa tan vừa hết 20(g) hỗn hợp hai oxit CuO và Fe2O3. Tính khối lượng của mỗi oxit trong hỗn hợp ban đầu
Đổi 200ml = 0,2 lít
Ta có: \(n_{HCl}=3,5.0,2=0,7\left(mol\right)\)
Gọi x, y lần lượt là số mol của CuO và Fe2O3
PTHH:
CuO + 2HCl ----> CuCl2 + H2O (1)
Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O (2)
Theo PT(1): \(n_{HCl}=2.n_{CuO}=2x\left(mol\right)\)
Theo PT(2): \(n_{HCl}=6.n_{Fe_2O_3}=6y\left(mol\right)\)
=> 2x + 6y = 0,7 (*)
Theo đề, ta có: 80x + 160y = 20 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}2x+6y=0,7\\80x+160y=20\end{matrix}\right.\)
=> x = 0,05, y = 0,1
=> \(m_{CuO}=80.0,05=4\left(g\right)\)
\(m_{Fe_2O_3}=20-4=16\left(g\right)\)
đổi 200ml = 0.2 l
nhcl = 0.2*3.5 = 0.7 ( mol)
gọi số mol của CuO là x
số mol của Fe2O3 là y
PTHH:
CuO + 2HCl ➜ CuCl2 + H2O
x 2x
Fe2O3 + 6HCl ➜ 2FeCl3 + 3H2O
y 6y
ta có hệ phương trình
\(\left\{{}\begin{matrix}80x+160y=20\\2x+6y=0,7\end{matrix}\right.\)
⇒ x= 0.05
y=0.1
mCuO= 0.05*80=4 (g)
mFe2O3= 0.1*160=16(g)
Phương trình hóa học:
CuO + 2HCl → CuCl2 + H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
Khối lượng của mỗi oxit trong hỗn hợp: x + y = 20
nHCl= 3,5 . 0,2 = 0,7 mol
Gọi khối lượng của CuO trong hỗn hợp là x và Fe2O3 là y (gam).
Từ (1) và (2) ta có:
{x+y=20x40+3y80=0,7{x+y=20x40+3y80=0,7
Giải hệ phương trình ta được x = 4 gam và y = 16 gam.
200ml dung dịch HCl có nồng độ 3,5M hòa tan hoàn toàn vừa hết 20g hỗn hợp hai oxit CuO và Fe2O3. Tính khối lượng mỗi oxit trong hỗn hợp ban đầu.
Giúp mik với
Gọi x,y là số mol của CuO,Fe2O3
Ta có: 80x+160y=20 (1)
nHCl= 3,5.0.,2 = 0,7
PTHH:2HCl + CuO → CuCl2 + H2O
Mol: 2x x
PTHH:6HCl + Fe2O3 → 2FeCl3 + 3H2O
Mol: 6y y
⇒ 2x+6y=0,7 (2)
Từ (1)(2)⇒ x=0,05;y=0,1
\(\Rightarrow m_{CuO}=0,05.80=4\left(g\right);m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
Để hòa tan hết 20 gam hỗn hợp CuO và Fe2O3 cần vừa đủ 200 ml dung dịch HCl 3,5M.
a.Tính khối lượng mỗi oxit trong hỗn hợp?
b.Tính nồng độ mol của các chất tan trong dung dịch sau phản ứng?
CuO + 2HCl -> CuCl2 + H2O (1)
Fe2O3 + 6HCl -> 2FeCl3 + 3H2O (2)
nHCl=0,2.3,5=0,7(mol)
Đặt nCuO=a
nFe2O3=b
Ta có hệ:
80a+160b=20
2a+6b=0,7
=>a=0,05;b=0,1
mCuO=80.0,05=4(g)
mFe2O3=20-4=16(g)
Theo PTHH 1 và 2 ta có:
nCuCl2=nCuO=0,05(mol)
nFeCl3=2nFe2O3=0,2(mol)
mCuCl2=135.0,05=6,75(g)
mFeCl3=162,5.0,2=32,5(g)
mdd =20+200.1,1=240(g)
C% dd CuCl2=6,72\240 .100%=2,8125%
C% dd FeCl3= 32,5\240 .100%=13,54%
200ml dung dịch HCl có nồng độ 3,5mol/lit hòa tan vừa đủ 20g hỗn hợp CuO và Fe2O3. a) Viết các phương trình phản ứng hóa học. b) Tính khối lượng của mỗi oxit bazơ có trong hỗn hợp ban đầu.
\(n_{CuO}=a\left(mol\right),n_{Fe_2O_3}=b\left(mol\right)\)
\(m=80a+160b=20\left(g\right)\left(1\right)\)
\(n_{HCl}=0.2\cdot3.5=0.7\left(mol\right)\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(n_{HCl}=2a+6b=0.7\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.05,b=0.1\)
\(m_{CuO}=0.05\cdot80=4\left(g\right)\)
\(m_{Fe_2O_3}=0.1\cdot160=16\left(g\right)\)
cho 200ml dd HCl 3,5M. hòa tan vừa hết 20g hỗn hợp hai oxit CuO và Fe2O3
a, tính khối lượng muối khan thu được sau phản ứng.
b, tính % theo khối lượng mỗi oxit trong hỗn hợp ban đầu.
giúp em với ạ ;-;
Đổi 200ml = 0,2 lít
Ta có: \(n_{HCl}=0,2.3,5=0,7\left(mol\right)\)
a. Gọi x, y lần lượt là số mol của CuO và Fe2O3.
PTHH:
CuO + 2HCl ---> CuCl2 + H2O (1)
Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O (2)
Theo PT(1): \(n_{HCl}=2.n_{CuO}=2x\left(mol\right)\)
Theo PT(2): \(n_{HCl}=6.n_{Fe_2O_3}=6y\left(mol\right)\)
\(\Rightarrow2x+6y=0,7\) (*)
Mà theo đề, ta có: \(80x+160y=20\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}2x+6y=0,7\\80x+160y=20\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
Theo PT(1): \(m_{CuCl_2}=n_{CuO}=0,05\left(mol\right)\)
\(\Rightarrow m_{CuCl_2}=0,05.135=6,75\left(g\right)\)
Theo PT(2): \(n_{FeCl_3}=2.n_{Fe_2O_3}=2.0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{FeCl_3}=0,2.162,5=32,5\left(g\right)\)
\(\Rightarrow m_{muối.khan}=6,75+32,5=39,25\left(g\right)\)
b. Từ câu a, suy ra:
\(\%_{m_{CuO}}=\dfrac{0,05.80}{20}.100\%=20\%\)
\(\%_{m_{Fe_2O_3}}=100\%-20\%=80\%\)
Đáp án: Giải thích các bước giải: Đổi 200ml = 0,2 lít Ta có: NHCL=0,2.3,5=0,7(mol) a. Gọi x, y lần lượt là số mol của CuO và Fe2o3 PTHH: Cuo + 2HCl ---> Cucl2+ H20(1) Fe2o3+ 6HCl ---> 2Fecl3+ 3H2O (2) Theo PT(1): nHCl=2.ncuo=2x(mol) Theo PT(2): nHCL=6.nf2o3=6y(mol) ⇒2x+6y=0,7 (*) Mà theo đề, ta có: 80x+160y=20 (**) Từ (*) và (**), ta có HPT: {2x+6y=0,780x+160y=20⇔{x=0,05y=0,1 Theo PT(1): mCucl2=nCuo=0,05(mol) ⇒mCucl2=0,05.135=6,75(g) Theo PT(2): nFecl3=2.nF2o3=2.0,1=0,2(mol) ⇒mFecl3=0,2.162,5=32,5(g) ⇒m muối.khan =6,75+32,5=39,25(g) b. Từ câu a, suy ra: %mcuo=0,05.8020.100%=20% %mfe2=100%−20%=80%
200 ml = 0,2l
nHCl = 0,2 . 3,5 = 0,7 ( mol)
Đặt x = nCuO, y = nFe2O3
CuO + 2HCl \(\rightarrow\) CuCl2 + H2O
x 2x x x (mol)
Fe2O3 + 6HCl \(\rightarrow\) 2FeCl3 + 3H2O
y 6y 2y 3y (mol)
80x + 160y = 20 (1)
2x + 6y = 0,7 (2)
Từ (1) và (2)
\(\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
a) mCuCl2 = 0,05. 135 = 6,75 (g)
mFeCl3 = 2.0,1.162,5
= 0,2 . 162,5 = 32,5(g)
b) m CuO = 0,05 . 80 = 4 (g)
%m CuO = \(\dfrac{4.100\%}{20\%}\)= 20%
mFe2O3 = 20 - 4 = 16 (g)
%m Fe3O3 = 100% - 20% = 80%
8. Cho hòa tan hoàn toàn 20 gam hỗn hợp 2 oxit gồm CuO và Fe2O3 dùng vừa đủ 255,5 gam dung dịch HCl 10%.
a. Viết các pthh và tính % khối lượng mỗi oxit trong hh đầu.
b. Tính nồng độ % của các muối trong dd sau phản ứng.
Hòa tan hoàn toàn 4,8 gam hỗn hợp X gồm CuO và Fe2O3 trong 200ml dung dịch HCl 1M thu được dung dịch Y. Trung hòa dung dịch Y cần vừa đủ 40 ml dung dịch NaOH 1M.
a. Tính % khối lượng mỗi oxit trong hỗn hợp ban đầu.
b. Cho từ từ đến dư dung dịch KOH vào dung dịch Y đến phản ứng hoàn toàn thu được kết tủa Z. Nung nóng kết tủa Z ngoài không khí đến khối lượng không đổi thu được m gam chất rắn. Tính m.
a)
nNaOH = 0,04.1 = 0,04 (mol)
PTHH: NaOH + HCl --> NaCl + H2O
0,04--->0,04
=> nHCl(pư với X) = 0,2.1 - 0,04 = 0,16 (mol)
Gọi số mol CuO, Fe2O3 là a, b (mol)
=> 80a + 160b = 4,8 (1)
PTHH: CuO + 2HCl --> CuCl2 + H2O
a----->2a
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
b----->6b
=> 2a + 6b = 0,16 (2)
(1)(2) => a = 0,02; b = 0,02
=> \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,02.80}{4,8}.100\%=33,33\%\\\%m_{Fe_2O_3}=\dfrac{0,02.160}{4,8}.100\%=66,67\%\end{matrix}\right.\)
b) Chất rắn thu được gồm CuO, Fe2O3
Bảo toàn Cu: nCuO = 0,02 (mol)
Bảo toàn Fe: nFe2O3 = 0,02 (mol)
=> m = 0,02.80 + 0,02.160 = 4,8 (g)
Hòa tan vừa hết 20 gam hỗn hợp CuO và F e 2 O 3 trong 200 ml dung dịch HCl 3,5M . Khối lượng mỗi oxit trong hỗn hợp là:
A. 4 g và 16 g
B. 10 g và 10 g
C. 8 g và 12 g
D. 14 g và 6 g
Chọn A
gọi x, y lần lượt là số mol của CuO và F e 2 O 3