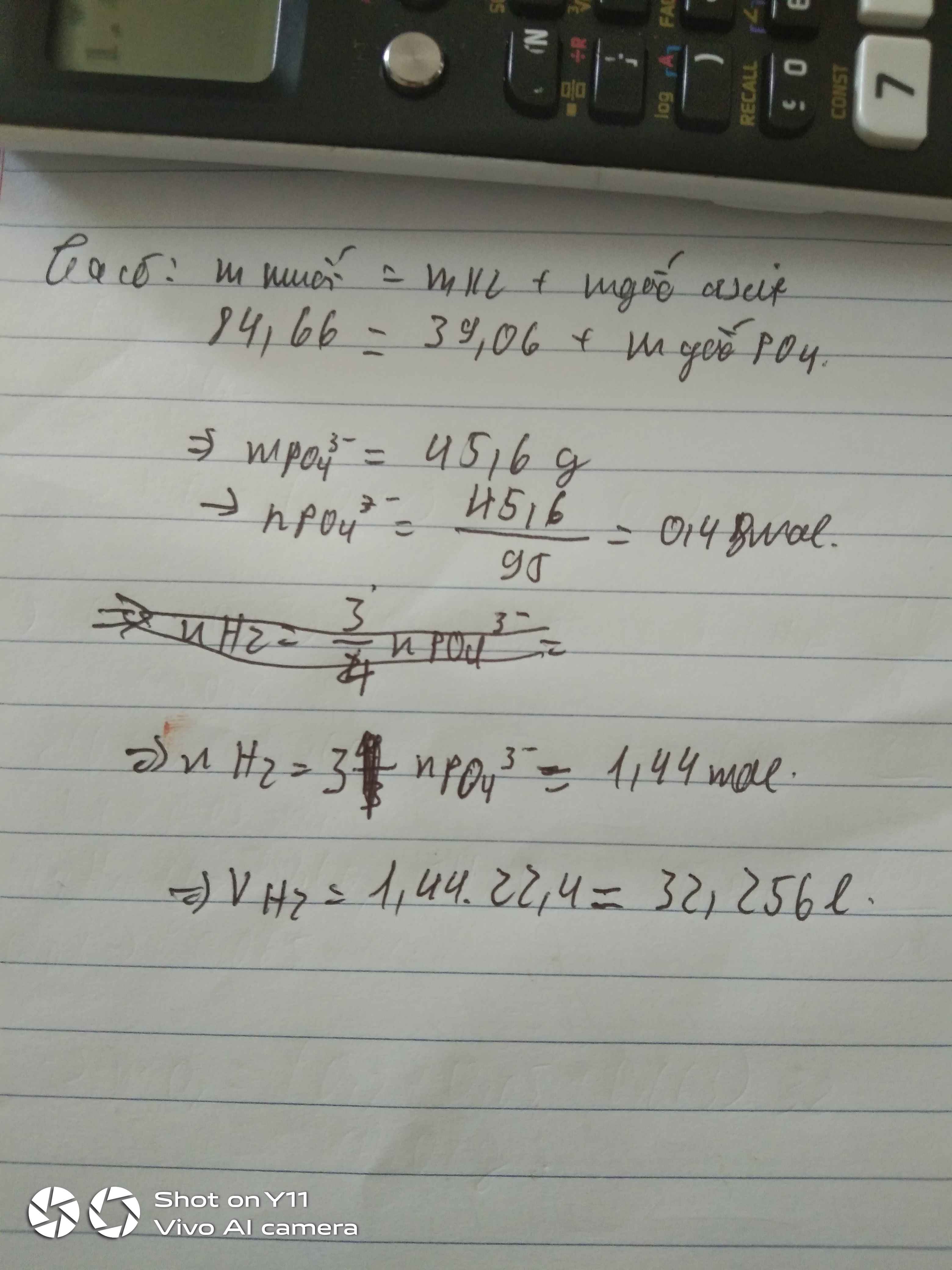Cho 5,4 gam Al vào dd NaOH dư . Tính thể tích khí H2 thu được ở đkc

Những câu hỏi liên quan
Cho 5,4 gam Al vào 200ml dd HCl 2M thì thu được bao nhiêu gam muối và bao nhiêu lít khí H2 (đkc) ?
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{HCl}=0,2.2=0,4\left(mol\right)\\ LTL:\dfrac{0,2}{2}>\dfrac{0,4}{6}\\ \Rightarrow Aldư\\ n_{AlCl_3}=\dfrac{1}{3}n_{HCl}=\dfrac{2}{15}\left(mol\right)\\ \Rightarrow m_{AlCl_3}=\dfrac{2}{15}.133,5=17,8\left(g\right)\\ n_{H_2}=\dfrac{1}{2}n_{H_2}=0,2\left(mol\right)\\ \Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(n_{HCl}=0.2\cdot2=0.4\left(mol\right)\)
=>HCl dư
\(n_{AlCl_3}=n_{Al}=0.2\left(mol\right)\)
\(m_{AlCl_3}=0.2\cdot133.5=26.7\left(g\right)\)
\(n_{HCl}=3\cdot0.2=0.6\left(mol\right)\)
hay \(n_{H_2}=0.3\left(mol\right)\)
\(V_{H_2}=0.3\cdot22.4=6.72\left(lít\right)\)
Đúng 1
Bình luận (0)
Bài 13: Cho 5,4 gam aluminium (Al) tác dụng với H2SO4
a. Tính thể tích khí H2 sinh ra (đkc )
b. Nếu dùng thể tích khí H2 thu được trên để khử iron (III) oxide (Fe2O3) thì thu được bao nhiêu gam iron (sắt)?
Bài 13:
a) \(n_{H_2}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,2---------------------------->0,3
=> VH2 = 0,3.24,79 = 7,437 (l)
b)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,3------->0,2
=> mFe = 0,2.56 = 11,2 (g)
Đúng 8
Bình luận (0)
Bài 13: Cho 5,4 gam aluminium (Al) tác dụng với H2SO4
a. Tính thể tích khí H2 sinh ra (đkc )
b. Nếu dùng thể tích khí H2 thu được trên để khử iron (III) oxide (Fe2O3) thì thu được bao nhiêu gam iron (sắt)?
a.\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.24,79=7,437l\)
b.\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,3 0,2 ( mol )
\(m_{Fe}=0,2.56=11,2g\)
Đúng 5
Bình luận (1)
tk
Bài 13:
a) nH2=5,4/27=0,2(mol)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,2---------------------------->0,3
=> VH2 = 0,3.24,79 = 7,437 (l)
b)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,3------->0,2
=> mFe = 0,2.56 = 11,2 (g)
Câu 25: Cho 5,4 gam Al t/d hoàn toàn với dd NaOH dư. Sau khi pư kết thúc, thể tích khí H2 (ở đktc) thoát ra là bao nhiêu?
Xem chi tiết
PTHH: \(Al+NaOH+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\uparrow\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\)
Đúng 1
Bình luận (0)
Cho 5,4 Al tác dụng với H2SO4 thu được 18g AL2SO43 và khí H2 a, tính hiệu suất phản ứng b, tính thể tích khí H2 thực tế thu được ĐKC
a) \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(n_{Al}=\dfrac{5,4}{54}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,05\left(mol\right)\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=0,05\cdot342=17,1\left(g\right)\)
Hiệu suất phản ứng là:
\(H=\dfrac{17,1}{18}\cdot100\%=95\%\)
b) Theo PTHH: \(n_{H_2}=\dfrac{0,1\cdot3}{2}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2,dkc}=0,15\cdot24,79=3,7185\left(l\right)\)
Đúng 2
Bình luận (0)
Cho 5,4 gam Al vào 0,5 mol H2SO4 a)Viết phương trình phản ứng b) Chất nào còn dư,tính khối lượng chất còn dư c)tính thể tích khí H2 thu được ở điều kiện xác định GIÚP MIK VỚI Ạ !
1. Hh gồm ZnO,MgOnặng 0.3g tan hết trong 17ml dd HCl 1M. Để trung hòa axit dư cần dùng 8 ml dd NaOH 05M. Tính % kl mỗi oxit2. 1 hh gồm Al, CuO cho vào dd Hcl dư thu được 3.72l khí. Mặt khác nếu cho hh trên vào dd NaOH 1M vừa đủ thấy thoát ra V khí H2 và thể tích dd NaOH cần dùng là 500ml. Tìm V3. Cho hoàn toàn 10 gam hh gồm Al, Al2O3 , Cu vào dd HCl dư thu được 3.36 lít khí, nhận dd A rắn B. Đốt A trong không khí đc 2.75 gam rắn Ca/ Tính klg mỗi chất trong hhb/ Nếu cho hh trên vào dd NaOH vừa đủ...
Đọc tiếp
1. Hh gồm ZnO,MgOnặng 0.3g tan hết trong 17ml dd HCl 1M. Để trung hòa axit dư cần dùng 8 ml dd NaOH 05M. Tính % kl mỗi oxit
2. 1 hh gồm Al, CuO cho vào dd Hcl dư thu được 3.72l khí. Mặt khác nếu cho hh trên vào dd NaOH 1M vừa đủ thấy thoát ra V khí H2 và thể tích dd NaOH cần dùng là 500ml. Tìm V
3. Cho hoàn toàn 10 gam hh gồm Al, Al2O3 , Cu vào dd HCl dư thu được 3.36 lít khí, nhận dd A rắn B. Đốt A trong không khí đc 2.75 gam rắn C
a/ Tính klg mỗi chất trong hh
b/ Nếu cho hh trên vào dd NaOH vừa đủ. Tính Vdd NaOH đã dùng
Giai3 hệ phương trình nha mấy bạn! Thanks nhìu!
Cho 39,06 gam hỗn hợp gồm Al, Mg, Fe phản ứng với dung dịch H3PO4 dư thì thu được 84,66 gam hỗn hợp muối khan. Thể tích của khí H2 ở đkc thu được là
Cho 5,4 gam Al tác dụng với 392 gam dung dịch H2SO4 10%. Thể tích H2 (đkc) thu được là:
\(n_{Al}=\dfrac{5,4}{27}=0,2mol\\ n_{H_2Ô_4SO_4}=\dfrac{392.10\%}{100\%.98}=0,4mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ \Rightarrow\dfrac{0,2}{2}< \dfrac{0,4}{3}\Rightarrow H_2SO_4.dư\\ n_{H_2}=n_{Al}=0,2mol\\ V_{H_2}=0,2.24,79=4,958l\)
Đúng 2
Bình luận (0)