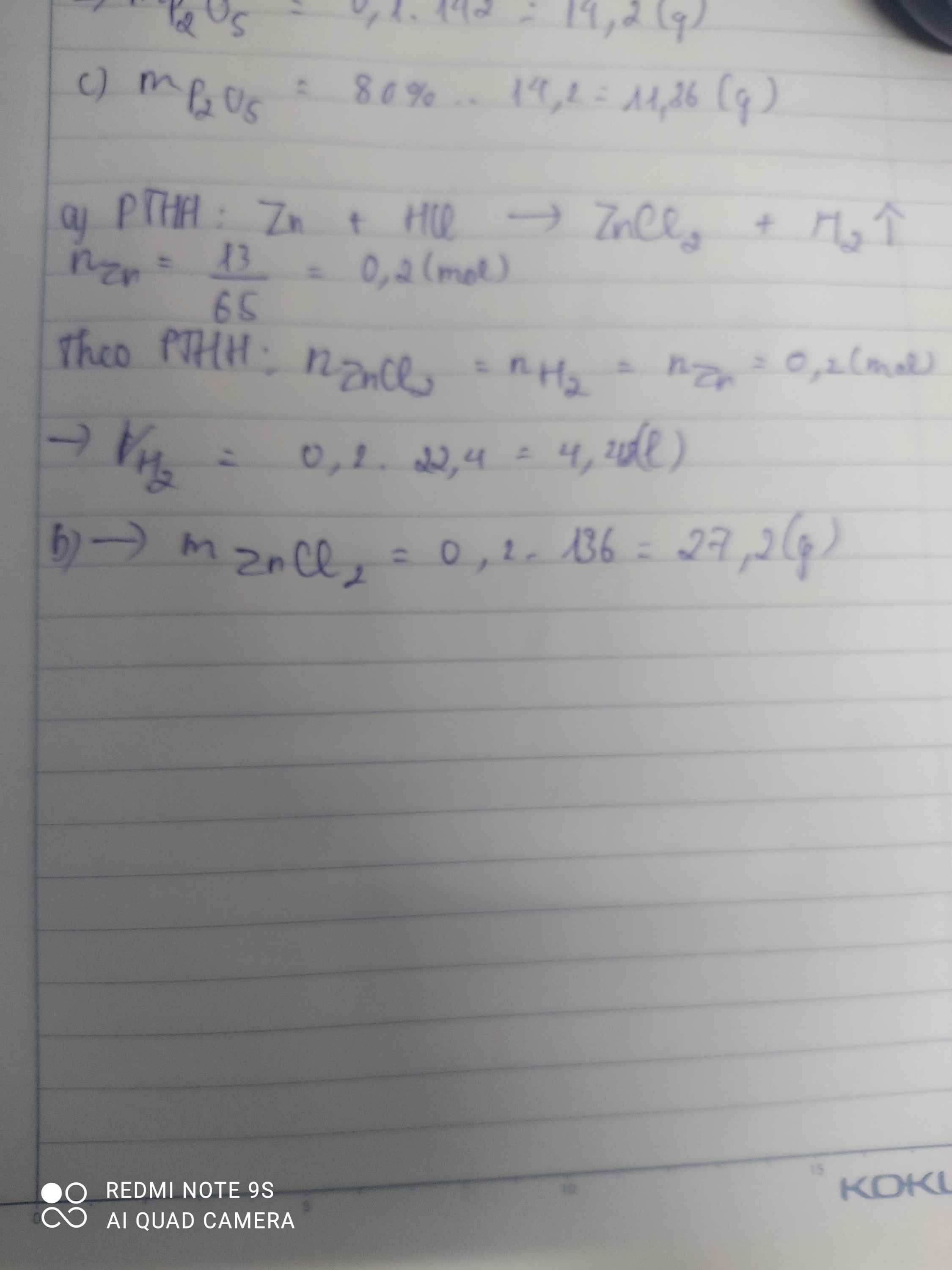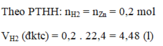Cho 13g Zn phản ứng với 4.48l O2. Tính Kl chất rắn sau phản ứng

Những câu hỏi liên quan
Bài 1: Đốt cháy 6,2(g) P trong bình chứa 6,72(l) khí O2 ở đktc.a. Sau phản ứng chất nào còn dư và nếu dư thì với khối lượng bao nhiêu? b. Tính khối lượng sản phẩm thu được. Bài 2: Cho 13g Zn tác dụng với 0,3 mol HCl sau khi kết thúc phản ứng thu được muối kẽm Clorua và khí H2.a. Viết và cân bằng PTPƯ và cho biết sau khi kết thúc phản ứng thì chất nào còn dư và nếu dư thì dư với khối lượng bao nhiêu?.b. Tính thể tích của H2 thu được.Bài 3: Người ta cho 26 g kẽm tác dụng với 49 g H2SO4, sau phả...
Đọc tiếp
Bài 1: Đốt cháy 6,2(g) P trong bình chứa 6,72(l) khí O2 ở đktc.
a. Sau phản ứng chất nào còn dư và nếu dư thì với khối lượng bao nhiêu? b. Tính khối lượng sản phẩm thu được.
Bài 2: Cho 13g Zn tác dụng với 0,3 mol HCl sau khi kết thúc phản ứng thu được muối kẽm Clorua và khí H2.
a. Viết và cân bằng PTPƯ và cho biết sau khi kết thúc phản ứng thì chất nào còn dư và nếu dư thì dư với khối lượng bao nhiêu?.
b. Tính thể tích của H2 thu được.
Bài 3: Người ta cho 26 g kẽm tác dụng với 49 g H2SO4, sau phản ứng thu được muối ZnSO4, khí hidro và chất còn dư.
a. Viết phương trình phản ứng.
b. Tính thể tích (đktc) khí hidro sinh ra.
c. Tính khối lượng các chất còn lại sau phản ứng.
Bài 4: Nếu cho 4 gam CuO tác dụng với 2,92 g HCl.
a) Cân bằng PTHH.
b) Tính khối lượng các chất còn lại sau phản ứng.
Bài 5: Hòa tan hoàn toàn 15gam CaCO3 vào 200mL dung dịch HCl 2M.
a. Chobiếtchấtnàodưsauphảnứng.
b. Tính nồng độ mol của các chất tan có trong dung dịch thu được.
Bài 6: Hòa tan hết 4,8 gam Magie vào 200 gam dung dịch H2SO4 loãng nồng độ 20%.
a. Chobiếtchấtnàodưsauphảnứng.
b. Tính nồng độ chất tan có trong dung dịch sau phản ứng.
Bài 7: Cho 200 ml dung dịch NaOH nồng độ 2M vào 200 mL dung dịch HCl 4M.
a. Chobiếtchấtnàodưsauphảnứng.
b. Tính nồng độ mol của chất tan trong dung dịch sau phản ứng.
Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)
Đúng 2
Bình luận (0)
b ơi đây là bài 1 nka, tí mk làm xog sẽ gửi típ nka ![]()
Đúng 0
Bình luận (5)
Có 3.6g C tác dụng với 4.48l O2 thu được CO và CO2. Tính % mỗi chất sau phản ứng
\(n_C=\dfrac{3,6}{12}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: C + O2 -to-> CO2
_____0,2<--0,2------>0,2_____(mol)
C + CO2 -to-> 2CO
0,1->0,1-------->0,2_________(mol)
=> \(\left\{{}\begin{matrix}n_{CO_2}=0,2-0,1=0,1\left(mol\right)\\n_{CO}=0,2\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{CO_2}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\\\%V_{CO}=\dfrac{0,2}{0,1+0,2}.100\%=66,67\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Cho 13g Zn tác dụng với 250g dung dịch CuSo4 20,%
a.Viết PT
b.tính mKL sau phản ứng
có.tính C% của các chất sau phản ứng
Xem chi tiết
a, PT: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu_{\downarrow}\)
b, Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(m_{CuSO_4}=\dfrac{250.20}{100}=50\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{50}{160}=0,3125\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3125}{1}\) , ta được CuSO4 dư.
Kim loại thu được sau pư là Cu.
Theo PT: \(n_{Cu}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)
b, Theo PT: \(n_{ZnSO_4}=n_{CuSO_4\left(pư\right)}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow n_{CuSO_4\left(dư\right)}=0,1125\left(mol\right)\)
Dung dịch thu được sau pư gồm: ZnSO4 và CuSO4 dư.
Ta có: m dd sau pư = mZn + m dd CuSO4 - mCu = 13 + 250 - 12,8 = 250,2 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{ZnSO_4}=\dfrac{0,2.161}{250,2}.100\%\approx12,87\%\\C\%_{CuSO_4\left(dư\right)}=\dfrac{0,1125.160}{250,2}.100\%\approx7,19\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 4
Bình luận (0)
cho 13g Zn tác dụng với 0,3 mol hcl sau phản ứng thu được a g zncl2 và V lít khí h2 (đktc)
a) viết phương trình phản ứng
b)sau phản ứng chất nào dư, dư bao nhiêu
c) tính a và V
\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2(mol)\)
Vì \(\dfrac{n_{Zn}}{1}>\dfrac{n_{HCl}}{2}\) nên Zn dư
\(\Rightarrow n_{Zn({\text{phản ứng})}}=\dfrac{1}{2}n_{HCl}=0,15(mol)\\ \Rightarrow n_{Zn(\text{dư})}=0,2-0,15=0,05(mol)\\ \Rightarrow m_{Zn(\text{dư})}=0,05.65=3,25(g)\\ c,n_{ZnCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,15(mol)\\ \Rightarrow a=m_{ZnCl_2}=0,15.136=20,4(g)\\ V=V_{H_2}=0,15.22,4=3,36(l)\)
Đúng 2
Bình luận (0)
\(a,Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ Ta.c\text{ó}:\dfrac{0,2}{1}>\dfrac{0,3}{2}\Rightarrow Zn.d\text{ư}\\ b,n_{Zn\left(d\text{ư}\right)}=0,2-\dfrac{0,3}{2}=0,05\left(mol\right)\\ \Rightarrow m_{Zn\left(d\text{ư}\right)}=0,05.65=3,25\left(g\right)\\ c,a=m_{ZnCl_2}=0,15.136=20,4\left(g\right)\\ V=V_{H_2\left(\text{đ}ktc\right)}=0,15.22,4=3,36\left(l\right)\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Cho 13g kim loại kẽm (zn) phản ứng hết với dung dịch axit Clohiđric ( HCL) a) tính thể tích khí hiđrô ở đktc b) tính khối lượng zn thu được sau phản ứng
\(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.2....................0.2..........0.2\)
\(m_{ZnCl_2}=0.2\cdot136=27.2\left(g\right)\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
Đúng 4
Bình luận (1)
Cho 13g Kẽm tác dụng với dd H2So4 20%
a) Tính thể tích chất khí tạo thành(ĐKTC)
b) Tính KL dd H2So4 20% dùng cho phản ứng.
c) Tính C% chất tan trong phản ứng.
giải em vs Đốt cháy hoàn toàn 0.3g hợp chất hữu cơ A thu được 0.224 dm3 khí CO2 ở đktc và 0.18g H2O. Lập công thức của A. vào câu hỏi của e trả lời e vs
Đúng 0
Bình luận (0)
cho 21,6g hỗn hợp Zn Fe Cu phản ứng vừa đủ với mg dung dịch H2SO4 25% .sau phản ứng thu được 6,72l khí ở dktc và 3g chất rắn không tan .
A, tính % khối lượng mỗi kim loại trong hỗn hợp đầu
B, Tính m
C, Tính C% của chất rắn trong dung dịch sau phản ứng
a, \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
mhh Zn và Fe = 21,6-3 = 18,6 (g)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: x x
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=18,6\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\%m_{Zn}=\dfrac{0,2.65.100\%}{21,6}=60,19\%\)
\(\%m_{Fe}=\dfrac{0,1.56.100\%}{21,6}=25,93\%\)
\(\%m_{Cu}=100-60,19-25,93=13,88\%\)
b,
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,2 0,2 0,2
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{H_2SO_4}=\left(0,1+0,2\right).98=29,4\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{29,4.100\%}{25\%}=117,6\left(g\right)\)
c,mdd sau pư = 21,6+117,6- (0,1+0,2).2 = 138,6 (g)
\(C\%_{ddZnSO_4}=\dfrac{0,2.161.100\%}{138,6}=23,23\%\)
\(C\%_{ddFeSO_4}=\dfrac{0,1.152.100\%}{138,6}=10,97\%\)
Đúng 2
Bình luận (1)
Cho 13g kẽm (Zn) vào dung dịch axit clohiđric (HCl) lấy dư, sau phản ứng hoàn toàn.
a, Viết PTHH của phản ứng.
b, Tính thể tích khí H2 (đktc) thoát ra?
c, Nếu cho 13g kẽm (Zn) ở trên vào 200g dung dịch HCl 9.125%, sau phản ứng hoàn toàn, tính khối lượng các chất tan trong dung dịch thu được?
Mk đang cần gấp, các bạn giúp mk vs ạ, camon các bn nhiều.
a, Zn + 2HCl ---> ZnCl2 + H2
b, nZn=\(\dfrac{13}{65}=0,2mol\)
Ta có: 1 mol Zn ---> 1 mol H2
nên 0,2 mol Zn ---> 0,2 mol H2
VH2=0,2.22,4=4,48 mol
Đúng 1
Bình luận (0)
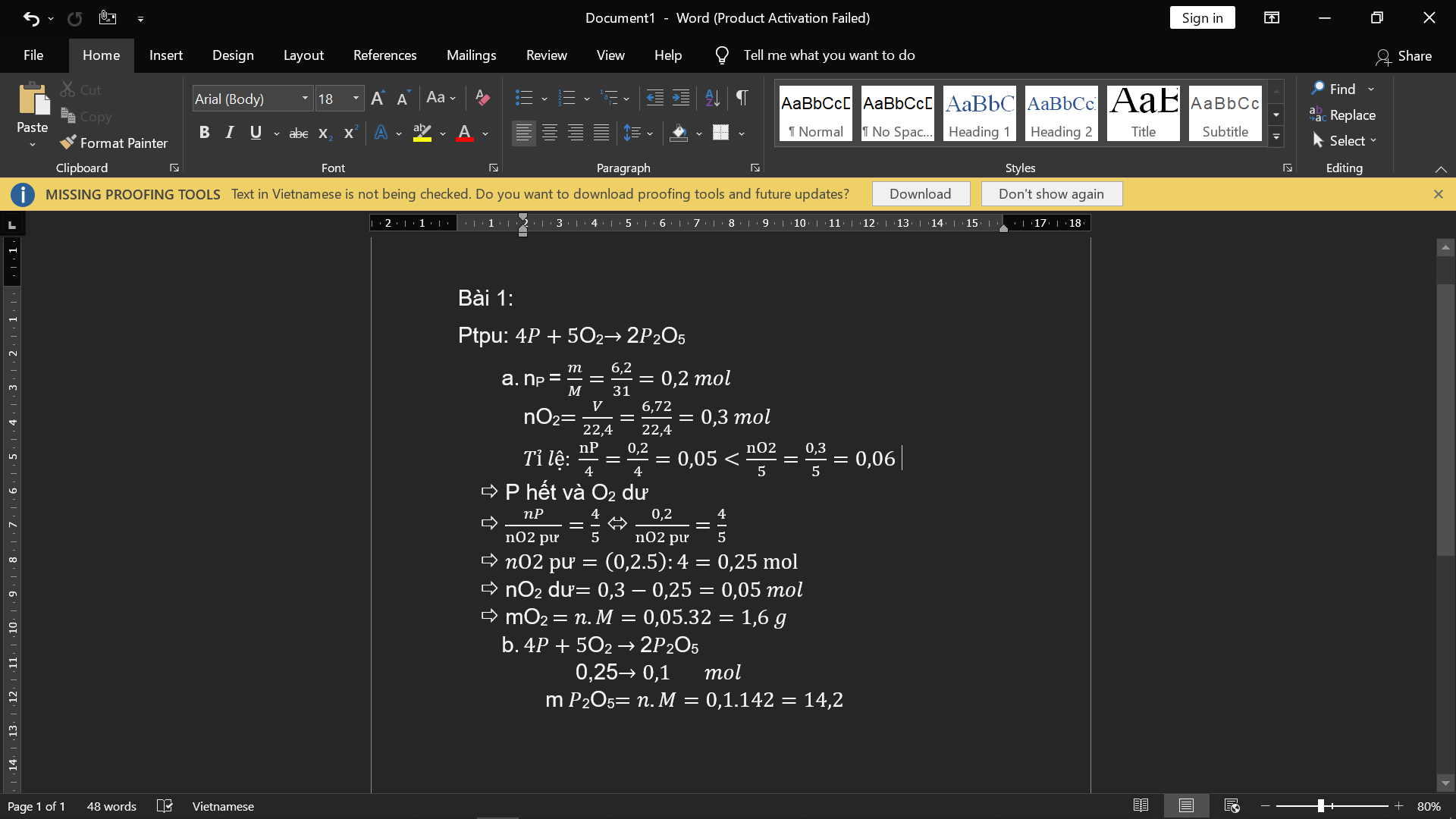
Cho 13g kẽm tác dụng với HCl theo sơ đồ phản ứng
Z n + H C l → Z n C l 2 + H 2
Tính thể tích khí H 2 (ĐKTC) đã sinh ra sau phản ứng