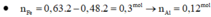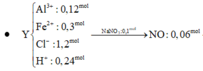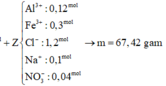cho 11,2 g fe td vs 9,6 g s. phản ứng xảy ra hoàn toàn thu đc hỗn hợp A. hòa tan A = m g dung dịch h2so4 98% đặc, nóng thì thu đc V lít khí B và dung dịch C.
a) tìm m và V
b) cho dung dịch C td vừa đủ vs dung dịch ba(oh)2. lọc kết tủa, nung đến khối lượng ko đổi đc chất rắn D. tính khối lượng D