Cho 2,23g hỗn hợp Al2O3, ZnO, MgO tác dụng vừa đủ với 200ml dd HCl 0,5M . Tính khối lượng muối clorua tạo ra trong dung dịch.

Những câu hỏi liên quan
cho 1.405 gam hỗn hợp gồm fe2o3,zno,mgo tác dụng vừa đủ với 500ml dung dịch hcl 0.1M. Khối lượng muối tạo ra của dung dịch
\(Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2O\\ ZnO + 2HCl \to ZnCl_2 + H_2O\\ MgO + 2HCl \to MgCl_2 + H_2O\\ n_{HCl} = 0,5.0,1 = 0,05(mol)\\ n_{H_2O} = \dfrac{1}{2}n_{HCl} = 0,025(mol)\\ \text{Bảo toàn khối lượng : }\\ m_{muối} = m_{hỗn\ hợp} + m_{HCl} - m_{H_2O} = 1,405 + 0,05.36,5 - 0,025.18 = 2,78(gam)\)
Đúng 2
Bình luận (1)
Cho 2,81 g hỗn hợp Fe2O3, ZnO, MgO tác dụng vừa đủ với 500 ml dung dịch H2SO4 0,1M. Tính khối lượng muối sunfat tạo ra trong dung dịch?
Tham khảo :
Oxit + H2SO4 = muối + H2O
Áp dụng định luật bảo toàn nguyên tố H
=> nH2O = nH2SO4 = 0,5.0,1 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng ta có:
=> m(oxit) + mH2SO4 = m(muối) + mH2O
=> m(muối)= 2,81 + 0,05.98 - 0.05.18 = 6,81g
Đúng 1
Bình luận (0)
Cho dung dịch HCl 0,5M tác dụng vừa đủ với 21,6 gam hỗn hợp A gồm Fe, FeO,
FeCO
3
. Thấy thoát ra một hỗn hợp khí có tỉ khối đối với
H
2
là 15 và tạo ra 31,75 gam muối clorua. Tính % khối lượng của mỗi chất trong hỗn hợp A.
Đọc tiếp
Cho dung dịch HCl 0,5M tác dụng vừa đủ với 21,6 gam hỗn hợp A gồm Fe, FeO, FeCO 3 . Thấy thoát ra một hỗn hợp khí có tỉ khối đối với H 2 là 15 và tạo ra 31,75 gam muối clorua. Tính % khối lượng của mỗi chất trong hỗn hợp A.
Phương trình hóa học :
Fe + 2HCl → FeCl 2 + H 2
FeO + 2HCl → FeCl 2 + H 2 O
FeCO 3 + 2HCl → FeCl 2 + H 2 O + CO 2
Tính % khối lượng: Gọi số mol Fe, FeO, FeCO 3 trong hỗn hợp là x, y, z => x + y + z = 0,25
Theo phương trình hóa học : Số mol H 2 , CO 2 là x, z
![]()
Mặt khác : 56x + 72y + 116z = 21,6
Giải ra ta có:
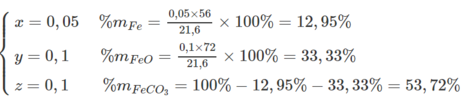
Đúng 0
Bình luận (1)
bài 1: cho 5g hỗn hợp bột oxit kim loại gồm ZnO,FeO,Fe2O3,Fe3O3,MgO tác dụng vừa hết với 200ml đ HCl 0,4M thu được dd X. Hỏi Lượng Muối trong đ X ? bài 2: cho m gam hỗn hợp các Oxit CuO,Fe2O3,ZnOtác dụng vừa đủ với 50ml đ HCl 2M. Cô cạn dung dịch sau phản ứng thu được 3,071 g muối clorua. giá trị của m là ?bài 3: oxi hoá 13,6 g hỗn hợp 2 kim loại thu được m gam hỗn hợp 2 oxit. Để hoà tan hoàn toàn m gam oxit này cần 500ml dd H2SO4 1M. Tính m
Đọc tiếp
bài 1: cho 5g hỗn hợp bột oxit kim loại gồm ZnO,FeO,Fe2O3,Fe3O3,MgO tác dụng vừa hết với 200ml đ HCl 0,4M thu được dd X. Hỏi Lượng Muối trong đ X ?
bài 2: cho m gam hỗn hợp các Oxit CuO,Fe2O3,ZnOtác dụng vừa đủ với 50ml đ HCl 2M. Cô cạn dung dịch sau phản ứng thu được 3,071 g muối clorua. giá trị của m là ?
bài 3: oxi hoá 13,6 g hỗn hợp 2 kim loại thu được m gam hỗn hợp 2 oxit. Để hoà tan hoàn toàn m gam oxit này cần 500ml dd H2SO4 1M. Tính m
Bài 1:
nHCl=0,08(mol)
nH2O=0,8/2=0,04(mol)
=>mO(trong H2O)= mO(trong oxit)=0,04. 16= 0,64(g)
=>m(Fe,Mg trong oxit)= 5 - 0,64= 4,36(g)
=> m(muối)= m(Fe,Mg) + mCl- = 4,36+ 0,08.35,5=7,2(g)
Đúng 3
Bình luận (0)
Bài 2:
nHCl=0,05.2=0,1(mol) => nCl- =0,1(mol) => mCl- = 0,1.35,5=3,55(g)
3,55> 3,071 => Em coi lại đề
Bài 3 em cũng xem lại đề hé
Đúng 1
Bình luận (0)
Cho dung dịch HCl 0,5M tác dụng vừa đủ với 21,6 gam hỗn hợp A gồm Fe, FeO, FeCO 3 . Thấy thoát ra một hỗn hợp khí có tỉ khối đối với H 2 là 15 và tạo ra 31,75 gam muối clorua. Tính thể tích dung dịch HCl đã dùng.
Phương trình hóa học :
Fe + 2HCl → FeCl 2 + H 2
FeO + 2HCl → FeCl 2 + H 2 O
FeCO 3 + 2HCl → FeCl 2 + H 2 O + CO 2
Tính thể tích dung dịch HCl :
n HCl = 2 n FeCl 2 = 2.31,75/127 = 0,5 mol
V HCl = 0,5/0,5 = 1l
Đúng 1
Bình luận (1)
Cho 15 gam hỗn hợp gồm Mg, MgO, Zn, ZnO, Al, Al2O3 (trong đó oxi chiếm 12,8%về khối lượng) tác dụng vừa đủ với dung dịch HCl thì thu được dung dịch X và 3,36 lít khí (đktc). Cô cạn dung dịch X được m gam muối khan. Tìm m
\(m_O=\dfrac{15.12,8}{100}=1,92\left(g\right)\)
=> \(n_O=\dfrac{1,92}{16}=0,12\left(mol\right)\)
=> \(n_{H_2O}=0,12\left(mol\right)\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Bảo toàn H: nHCl = 0,12.2 + 0,15.2 = 0,54 (mol)
=> nCl = 0,54 (mol)
mmuối = mhh rắn - mO + mCl
= 15 - 1,92 + 0,54.35,5 = 32,25 (g)
Đúng 2
Bình luận (0)
Cho 13,6 g hỗn hợp FE FE2O3 tác dụng vừa đủ với 1 lít dung dịch HCl 0,5M . Tính khối lượng các muối clorua thu đc
Xem chi tiết
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (1)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\) (2)
Ta có: \(\Sigma n_{HCl}=1\cdot0,5=0,5\left(mol\right)\)
Gọi số mol của Fe là \(a\) \(\Rightarrow n_{HCl\left(1\right)}=2a\)
Gọi số mol của Fe2O3 là b \(\Rightarrow n_{HCl\left(2\right)}=6b\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}2a+6b=0,5\\56a+160b=13,6\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{FeCl_2}=0,1mol\\n_{FeCl_3}=0,1mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_2}=0,1\cdot127=12,7\left(g\right)\\m_{FeCl_3}=0,1\cdot162,5=16,25\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{muối}=12,7+16,25=28,95\left(g\right)\)
Đúng 2
Bình luận (0)
Đặt :
nFe = x mol
nFe2O3 = y mol
mhh = 56x + 160y = 13.6 (g) (1)
Fe + 2HCl => FeCl2 + H2
x_____2x
Fe2O3 + 6HCl => 2FeCl3 + 3H2O
y________6y
nHCl = 2x + 6y = 0.5 (2)
(1) , (2) :
x = 0.1
y = 0.05
mFeCl2 = 0.1*127 = 12.7 (g)
mFeCl3 = 0.1*162.5 = 16.25 (g)
Đúng 0
Bình luận (0)
Cho 1,405 gam hỗn hợp Fe2O3, ZnO, MgO tác dụng vừa đủ với 250 ml dung dịch H2SO4 0,1M. Khối lượng muối tạo thành trong dung dịch là bao nhiêu?
\(n_{H_2SO_4}=0.1\cdot0.25=0.025\left(mol\right)\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(TừPTHH:\)
\(n_{H_2SO_4}=n_{H_2O}=0.025\left(mol\right)\)
\(BTKL:\)
\(m_{Muối}=1.405+0.025\cdot98-0.025\cdot18=3.405\left(g\right)\)
Đúng 2
Bình luận (0)
cho hỗn hợp NaOH và KOH tác dụng vừa đủ với 200ml dung dịch HCl 1M. Sau phản ứng thu được 13,3g muối Clorua. Tìm % khối lượng mỗi hidroixt trong hỗn hợp
\(NaOH+HCl\rightarrow NaCl+H_2O\left(1\right)\\ KOH+HCl\rightarrow KCl+H_2O\left(2\right)\\ Tathấyởpứ\left(1\right),\left(2\right):n_{H_2O}=n_{HCl}=0,2\left(mol\right)\\ BTKL:m_{hh.hidroxit}+m_{HCl}=m_{muối}+m_{H_2O}\\ \Rightarrow m_{hh.hidroxit}=13,3+0,2.18-0,2.36,5=9,6\left(g\right)\\ Đặt:\left\{{}\begin{matrix}n_{NaOH}=x\left(mol\right)\\n_{KOH}=y\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}40x+56y=9,6\\58,5x+74,5=13,3\end{matrix}\right.\\\Rightarrow \left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\\ \Rightarrow\%NaOH=41,67\%;\%KOH=58,33\%\)
Đúng 2
Bình luận (0)




















