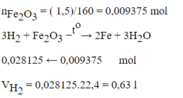Khử 12 gam sắt(III) oxit bằng khí Hidro .Tính thể tích khí Hidro cần dùng ở (đktc)

Những câu hỏi liên quan
Khử 16 gam sắt III oxit bằng khí hidro tính thể tích khí hidro đktc cần dùng là
n Fe2O3 = 16/160 = 0,1(mol)
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2F e+3H_2O$
n H2 = 3n Fe2O3 = 0,1.3 = 0,3(mol)
V H2 = 0,3.22,4 = 6,72 lít
Đúng 1
Bình luận (0)
Khử 12g Sắt ( III ) oxit bằng khí Hidro
a) Tính thể tích khí Hidro ( ở đktc) cần dùng
b) Tính khối lượng sắt thu đc sau phản ứng
Số mol của sắt (III) oxit
nFe2O3 = \(\dfrac{m_{Fe2O3}}{M_{Fe2O3}}=\dfrac{12}{160}=0,075\left(mol\right)\)
Pt : 3H2 + Fe2O3 → 2Fe + 3H2O\(|\)
3 1 2 3
0,225 0,075 0,15
a) Số mol của khí hidro
nH2 = \(\dfrac{0,075.3}{1}=0,225\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,225 . 22,4
= 5,04 (l)
b) Số mol của sắt
nFe= \(\dfrac{0,075.2}{1}=0,15\left(mol\right)\)
Khối lượng của sắt thu được
mFe = nFe . MFe
= 0,15 . 56
= 8,4 (g)
Chúc bạn học tốt
Đúng 2
Bình luận (1)
Khử hoàn toàn Sắt(III)Oxit bằng khí Hidro ở nhiệt độ cao thu được kim loại và 10,8 g nước.
a. Tính thể tích khí Hidro cần dùng ở Đktc?
b. Tính khối lượng kim loại sau phản ứng?
Tính khối lượng Sắt(III)Oxit cần dùng?
Fe2O3+3H2-to>2Fe+3H2O
0,2----------0,6------0,4-----0,6 mol
n H2O=\(\dfrac{10,8}{18}\)=0,6 mol
=>VH2=0,6.22,4=13,44l
b)m Fe=0,4.56=22,4g
c) m Fe2O3=0,2.160=32g
Đúng 2
Bình luận (0)
khử 32g sắt (III) oxit bằng khí hidro hãy
A)tính số gam sắt sinh ra đs 22,4g
b) thể tích khí hidro dktc cần dùng đs 6,72 lít
\(n_{Fe_2o_3}=\dfrac{36}{160}=0,2\left(m\right)\)
\(PTHH:Fe_2O_3+3H_2\xrightarrow[]{}2Fe+3H_2O\)
tỉ lệ :1 3 2 3
số mol :0,2 0,6 0,4 0,6
\(m_{Fe}=0,4.56=22,4\left(g\right)\)
b)\(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
Đúng 1
Bình luận (0)
Khử 12g sắt(III) oxit bằng hidro
A tính thể tích khí Hidro(ở đktc) cần dùng
B tính khối lượng sắt thu được sau phản ứng
\(n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{t^0}2Fe+3H_2O\)
\(0,075\rightarrow0,225\) \(0,15\)
\(V_{H_2}=0,225.22,4=5,04\left(l\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
Đúng 1
Bình luận (0)
khử 14,4 gam sắt (III) oxit oxit FeO bằng khí hidro thu được kim loại sắt và nước a Tính thể tích của khí hidro cần dùng b Tính khối lượng kim loại sắt thu được
\(n_{Fe_2O_3}=\dfrac{14.4}{160}=0.09\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{t^0}}2Fe+3H_2O\)
\(0.09.........0.27...0.18\)
\(V_{H_2}=0.27\cdot22.4=6.048\left(l\right)\)
\(m_{Fe}=0.18\cdot56=10.08\left(g\right)\)
Đúng 0
Bình luận (1)
PTHH: \(FeO+H_2\longrightarrow Fe+H_2O\)
a/ \(n_{FeO}=\dfrac{m_{FeO}}{M_{FeO}}=\dfrac{14,4}{72}=0,2(mol)\)
\(\to n_{H_2}=0,2(mol)\)
\(\to V_{H_2}=0,2.22,4=4,48(l)\)
b/ \(n_{Fe}=n_{H_2}=0,2(mol)\)
\(\to m_{Fe}=0,2.56=11,2(g)\)
Đúng 1
Bình luận (0)
n F e 2 O 3 = 14.4 160 = 0.09 ( m o l ) F e 2 O 3 + 3 H 2 t 0 → 2 F e + 3 H 2 O 0.09.........0.27...0.18 V H 2 = 0.27 ⋅ 22.4 = 6.048 ( l ) m F e = 0.18 ⋅ 56 = 10.08 ( g )
Đúng 0
Bình luận (0)
Khử hoàn toàn 1,5 g sắt (III) oxit bằng khí H 2 . Thể tích khí hidro (đktc) cần dùng là
A. 2,34 l
B. 1,2 l
C. 0,63 l
D. 0,21 l
Người ta dùng khí hidro hoặc khí cacbn oxit để khử sắt (III) oxit thành sắt. Để điều chế 35g sắt, thể tích khí hidro và thể tích hí cacbon oxit(các đo ở đktc)
Ta có: \(n_{Fe}=\dfrac{35}{56}=0,625\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,9375\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,9375.22,4=21\left(l\right)\)
PT: \(Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
Theo PT: \(n_{CO}=\dfrac{3}{2}n_{Fe}=0,9375\left(mol\right)\)
\(\Rightarrow V_{CO}=0,9375.22,4=21\left(l\right)\)
Đúng 1
Bình luận (0)
Cho 6,5 gam kẽm tác dụng hết với axit clohidrit HCla)Viết Phương trình phản ứng dã xảy ra b)Tính thể tích khí hidro sinh ra ở ĐKTCc)Nếu dùng thể tích khí hidro này để khử 3,2 gam sắt (III) trong oxit Fe2O3 . Tính khối lượng sắt (III) oxit cần đem phả...
Xem chi tiết
\(a) Zn + 2HCl \to ZnCl_2 + H_2\\ b) n_{H_2} = n_{Zn} = \dfrac{6,5}{65} = 0,1(mol)\\ V_{H_2} = 0,1.22,4 = 2,24(lít)\\ c) n_{Fe_2O_3} = \dfrac{3,2}{160} = 0,02(mol)\\ Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\\ 3n_{Fe_2O_3} = 0,02.3 = 0,06 < n_{H_2} = 0,1 \to H_2\ dư\)
Vậy lượng sắt III oxit trên phản ứng hết với lượng hidro sinh ra.
Đúng 2
Bình luận (0)
a) PTPƯ: Zn + 2 HCl → Zn\(_{ }Cl_2\) + \(_{_{ }}H_2\)
\(_{ }n_{Zn}\) = \(\dfrac{6,5}{65}\) = 0,1 ( mol)
Theo PTPƯ: để có 1 mol \(_{_{ }}H_2\) cần 1 mol Zn
⇒ có 0,1 mol Zn sẽ tạo ra 0,1 mol \(_{_{ }}H_2\)
\(_{ }V_{H_2}\) = n. 22,4 = 0,1 . 22,4 = 2,24 ( l)
c)
PTPƯ: 3 \(_{ }H_2\) + \(_{ }Fe_2O_3\) → 3 \(_{ }H_2O\) + 2Fe
tỉ lệ: 3 : 1 : 3 : 2
Số mol: 0,1 : \(\dfrac{1}{30}\)
\(_{ }m_{Fe_2O_3}\) = \(\dfrac{1}{30}\) . 160 = 5,3 ( g)
Đúng 0
Bình luận (0)
khử 50 g hỗn hợp đồng (II) oxit và sắt (III) oxit bằng khí hidro. tính thể tích khí hidro cần dùng. biết rằng trong hỗn hợp đồng (II)oxit chiếm 20% về kl:
A.tính thể tích khí hiđro (đktc)cần dùng cho phản ứng trên
B.tích khối lượng mỗi kim loại thu đc sau phản ứng
\(m_{CuO}=50.20\%=10\left(g\right)\)
\(n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\)
\(m_{Fe_2O_3}=50-10=40\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{40}{160}=0,25\left(mol\right)\)
PTHH :
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,125 0,125 0,125
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,25 0,75 0,5
\(a,V_{H_2}=\left(0,75+0,125\right).22,4=19,6\left(l\right)\)
\(b,m_{Cu}=0,125.64=8\left(g\right)\)
\(m_{Fe}=0,5.56=28\left(g\right)\)
Đúng 1
Bình luận (0)