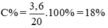Đun nhẹ 20 g dung dịch CuSO4 cho đến khi nước bày hơi hết, người ta thu được chất rắn màu trắng là CuSO4 khan. Chất này có khối lượng là 3,6 g. Hãy xác định nồng độ phần trăm của dung dịch CuSO4

Những câu hỏi liên quan
Đun nhẹ 20 gam dung dịch CuSO 4 cho đến khi nước bay hơi hết, người ta thu được chất rắn màu trắng là CuSO 4 khan. Chất này có khối lượng là 3,6 gam. Hãy xác định nồng độ phần trăm của dung dịch CuSO 4 ban đầu.
Nồng độ phần trăm của dung dịch CuSO 4 :
Đúng 0
Bình luận (0)
Đun nhẹ 20g dung dịch CuSO4 cho đến khi nước bay hơi hết, người ta thu được chất rắn màu trắng là CuSO4 khan. Chất này có khối lượng là 3,6g. Hãy xác định nồng độ phần trăm của dung dịch CuSO4.
Đun nhẹ 20 g dung dịch CuSO4 cho đến khi nước bày hơi hết, người ta thu được chất rắn màu trắng là CuSO4 khan. Chất này có khối lượng là 3,6 g. Hãy xác định nồng độ phần trăm của dung dịch CuSO4
Nồng độ phần trăm của dung dịch:
C% = . 100% =
. 100% = 18%
Đúng 0
Bình luận (0)
nồng độ % của dung dịch \(CuSO_4\) là
\(\frac{3,6}{20}.100\%=18\%\)
Đúng 0
Bình luận (0)
Nồng độ % của dung dịch CuSO4 là:
mdung dịch =\(\frac{3,6}{20}x100\%=18\%\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Đun nhẹ 20 g dung dịch CuSO4 cho đến khi nước bày hơi hết, người ta thu được chất rắn màu trắng là CuSO4 khan. Chất này có khối lượng là 3,6 g. Hãy xác định nồng độ phần trăm của dung dịch CuSO4
Nồng độ phần trăm của dung dịch:
C% = . 100% =
. 100% = 18%
Đúng 0
Bình luận (0)
nồng độ % của dung dịch \(CuSO_4\) là
\(\frac{3,6}{20}.100\%=18\%\)
Đúng 0
Bình luận (0)
Nồng độ phần trăm của dung dịch \(CuSO_4\) là :
\(\dfrac{3,6}{20}.100\%=18\%\)
Vậy nồng độ phần trăm của dung dịch \(CuSO_4\) là 18%.
Đúng 0
Bình luận (0)
Một dung dịch
C
u
S
O
4
có khối lượng riêng là 1,206g/ml. Khi cô cạn 165,84ml dung dịch này người ta thu được 36g
C
u
S
O
4
. Hãy xác định nồng độ phần trăm của dung dịch
C
u
S
O
4
đã dùng.
Đọc tiếp
Một dung dịch C u S O 4 có khối lượng riêng là 1,206g/ml. Khi cô cạn 165,84ml dung dịch này người ta thu được 36g C u S O 4 . Hãy xác định nồng độ phần trăm của dung dịch C u S O 4 đã dùng.
Khối lượng dung dịch C u S O 4 ban đầu:
m d d = V.D = 165,84.1,206=200(g)
Nồng độ % của dung dịch C u S O 4 :
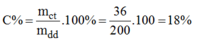
Đúng 0
Bình luận (0)
người ta cho vào 183,5g nước hỗn hợp CuSO4 khan và CuSO4.%H2O có khối lượng tổng là 16,5 g. dung dịch thu được có nồng độ 6%. tính khối lượng các chất trong hỗn hợp
Đặt a,b là số mol CuSO4 và CuSO4.5H2O
_> 160a + 250b = 16,5
Sau pha trộn mdd= 183,5+16,5= 200 gam
_> nCuSO4 tổng= a +b=200.6%/160
_> a= 0,025 và b = 0,05
mCuSO4= 160a=4gam
mCuSO4.5H2O = 250b = 12,5 gam
Đúng 0
Bình luận (0)
1. Một dung dịch CuSO4 (gọi là dung dịch X) có khối lượng riêng là 1,6 g/ml. Nếu đun nhẹ 25 ml dung dịch để làm bay hơi nước thì thu được 11,25 gam tinh thể CuSO4.5H2O. a) Tính nồng độ phần trăm và nồng độ mol của dung dịch X. b) Lấy 200 gam dung dịch X làm lạnh đến t0C thấy tách ra 5,634 gam tinh thể CuSO4.5H2O. Tính độ tan của CuSO4 ở t0C. 2. Trên hai đĩa cân để 2 cốc đựng 90 gam dung dịch HCl 7,3% (cốc 1) và 90 gam dung dịch H2SO4 14,7% (cốc 2) sao cho cân ở vị trí thăng bằng. - Thêm vào...
Đọc tiếp
1. Một dung dịch CuSO4 (gọi là dung dịch X) có khối lượng riêng là 1,6 g/ml. Nếu đun nhẹ 25 ml dung dịch để làm bay hơi nước thì thu được 11,25 gam tinh thể CuSO4.5H2O.
a) Tính nồng độ phần trăm và nồng độ mol của dung dịch X.
b) Lấy 200 gam dung dịch X làm lạnh đến t0C thấy tách ra 5,634 gam tinh thể CuSO4.5H2O. Tính độ tan của CuSO4 ở t0C.
2. Trên hai đĩa cân để 2 cốc đựng 90 gam dung dịch HCl 7,3% (cốc 1) và 90 gam dung dịch H2SO4 14,7% (cốc 2) sao cho cân ở vị trí thăng bằng.
- Thêm vào cốc thứ nhất 10 gam CaCO3.
- Thêm vào cốc thứ hai y gam Zn thấy kim loại tan hoàn toàn và thoát ra V’ lít khí hidro (đktc). a) Viết các PTHH xảy ra.
b) Sau các thí nghiệm, thấy cân vẫn thăng bằng. Tính giá trị y và V’. (Kết quả lấy 3 chữ số sau dấu phẩy)
1)
\(m_{ddCuSO_4\left(bd\right)}=1,6.25=40\left(g\right)\)
\(n_{CuSO_4.5H_2O}=\dfrac{11,25}{250}=0,045\left(mol\right)\)
=> \(n_{CuSO_4}=0,045\left(mol\right)\)
\(C_M=\dfrac{0,045}{0,025}=1,8M\)
\(C\%=\dfrac{0,045.160}{40}.100\%=18\%\)
b)
\(m_{CuSO_4}=\dfrac{200.18}{100}=36\left(g\right)\)
\(n_{CuSO_4.5H_2O}=\dfrac{5,634}{250}=0,022536\left(mol\right)\)
nCuSO4 (tách ra) = 0,022536 (mol)
=> \(m_{CuSO_4\left(dd.ở.t^o\right)}=36-0,022536.160=32,39424\left(g\right)\)
\(m_{H_2O\left(bd\right)}=200-36=164\left(g\right)\)
nH2O (tách ra) = 0,022536.5 = 0,11268 (mol)
=> \(m_{H_2O\left(dd.ở.t^o\right)}=164-0,11268.18=161,97176\left(g\right)\)
\(S_{t^oC}=\dfrac{32,39424}{161,97176}.100=20\left(g\right)\)
Đúng 2
Bình luận (0)
cho một lá sắt có khối lượng 4,2 gam vào 40 g dung dịch cuso4 20% sau một thời gian phẩn ứng lấy lá sắt ra khỏi dung dịch rửa nhẹ làm khô cho lên cân thì được khối lượng 4,5 g hãy tính nồng độ phần trăm các chất sau pư
\(n_{CuSO_4}=\dfrac{40.20}{100}:160=0,05\left(mol\right)\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
x x x x
Gọi x là số mol Fe pứ.
có: \(64x-56x=4,5-4,2=0,3\)
<=> 8x = 0,3
=> x = 0,0375
=> \(n_{Fe\left(pứ\right)}=n_{CuSO_{4\left(pứ\right)}}=n_{FeSO_{4\left(pứ\right)}}=x=0,0375\left(mol\right)\)
Vì: \(\dfrac{0,0375}{1}< \dfrac{0,05}{1}\) nên dd \(CuSO_4\) dư sau pứ là: \(0,05-0,0375=0,0125\left(mol\right)\)
Có: \(m_{dd}=4,2+40-4,5=39,7\left(g\right)\)
\(C\%_{dd.CuSO_{4\left(sau.pứ\right)}}=\dfrac{0,0125.160.100}{39,7}=5,04\%\)
\(C\%_{dd.FeSO_4}=\dfrac{0,0375.152.100}{39,7}=14,36\%\)
Đúng 1
Bình luận (0)
Câu 4 (4 điểm): Hòa 99,8 g CuSO4 vào 164 g H2O. Làm lạnh dung dịch tới 100C thu được 30 g tinh thể CuSO4. 5H2O. Biết độ tan của CuSO4 khan ở 100C là 17,4 g.
Xác định xem CuSO4. 5H2O ban đầu có lẫn tạp chất hay tinh khiết? Tính khối lượng tạp chất nếu có.
một dung dịch cuso4 có khối lượng riêng là 1,206 g/ml . khi cô cạn 165,84 ml dung dịch này người ta thu được 36g cuso4 . hãy xác định nồng độ phần trăm của dung dịch cuso4 đã dùng
Theo de bai ta co
mddCuSO4=D.V=1,206.165,84\(\approx\)200 g
\(\Rightarrow\)Nong do % cua dd CuSO4 da dung la
C%=\(\dfrac{mct}{mdd}.100\%=\dfrac{36}{200}.100\%=18\%\)
Đúng 0
Bình luận (0)