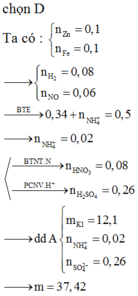
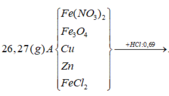
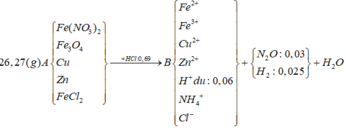
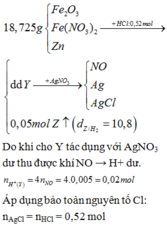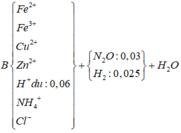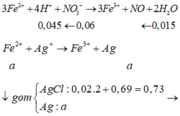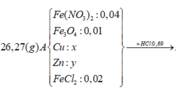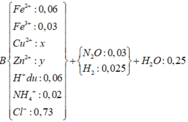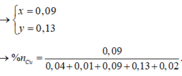Cho 8,85 gam hỗn hợp Zn và Fe (tỉ lệ về số mol giữa Zn và Fe là 1:2) vào dung dịch có chúa 21,9 gam HCl
a) Tính thể tích H2 (đktc) thu được
b) Cho toàn bộ khí H2 nói trên qua 24 gam hỗn hợp CuO, Fe3O4nung nóng. Sau khi phản ứng kết thúc thu được m gam chất rắn. Tính m