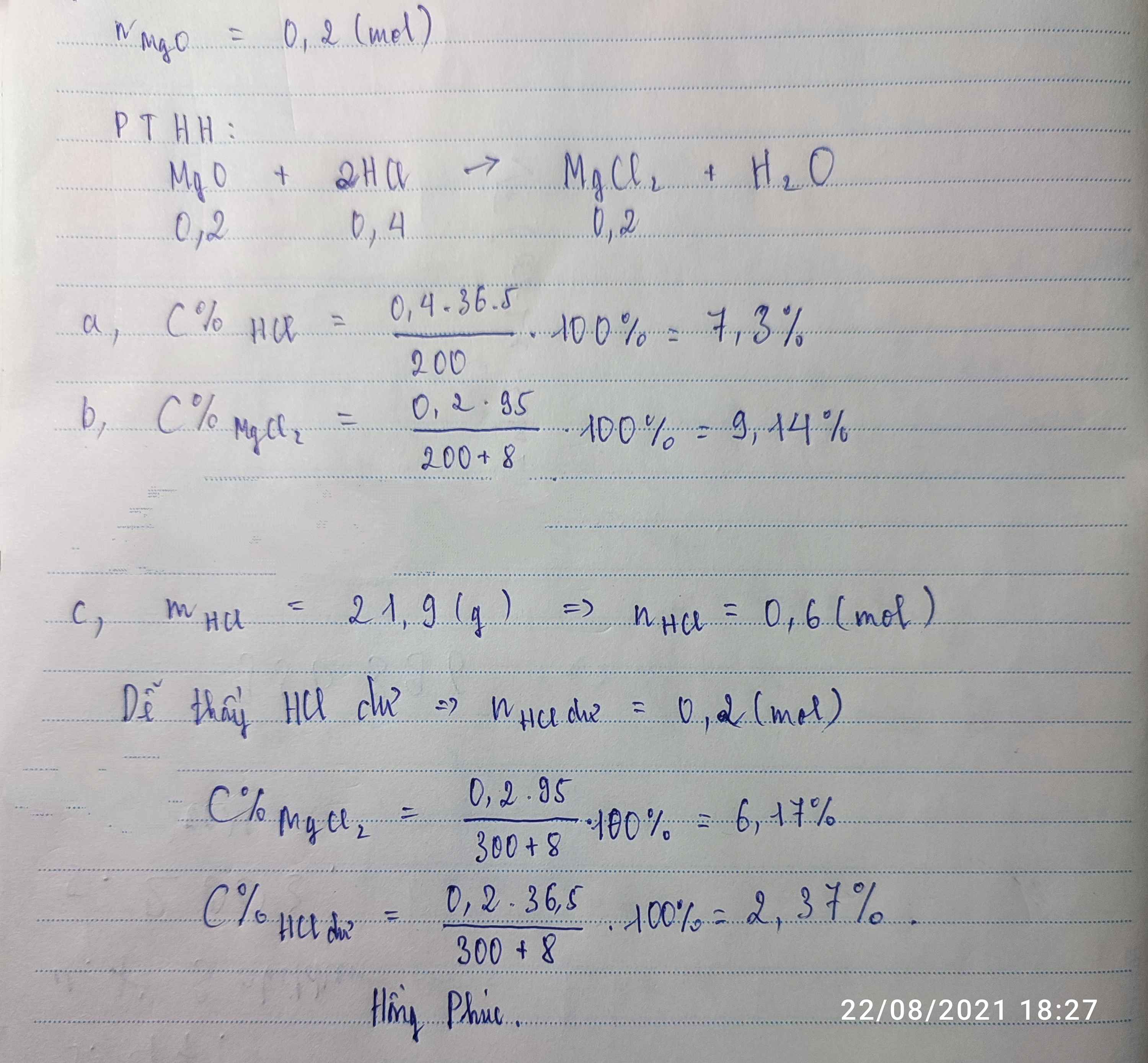hòa tan 5,6g Fe vào 300g hcl 3,65 %. tính C% dd mới

Những câu hỏi liên quan
hòa tan 5,6g Fe vào 300g đ HCl 3,65%. tính C% của dd sau pứ
Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Khối lượng của axit clohidric C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{3,65.300}{100}=10,95\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,1 0,3 0,1 0,1
Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\)
⇒ Fe phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol Fe
Số mol của sắt clorua
nFeCl2 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của sắt clorua
mFeCl2 = nFeCl2 . MFeCl2
= 0,1 . 127
=12,7 (g)
Số mol dư của axit clohidric
ndư = nban đầu - nmol
= 0,3 - (0,1 . 2)
= 0,1 (mol)
Khối lượng dư của axit clohidric
mdư = ndư . MHCl
= 0,1 . 36,5
= 3,65 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mH2SO4 - mH2
= 5,6 + 300 - (0,1 . 2)
= 305,4 (g)
Nồng độ phần trăm của sắt clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{12,7.100}{305,4}=4,16\)0/0
Nồng độ phần trăm của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{3,65.100}{305,4}=1,19\)0/0
Chúc bạn học tốt
Đúng 4
Bình luận (0)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\ m_{HCl}=\dfrac{300.3,65}{100}=10,95\left(g\right)\\ n_{HCl}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\\ \dfrac{n_{HCl}}{n_{Fe}}=\dfrac{0,3}{0,1}=\dfrac{3}{1}>\dfrac{2}{1}\)
Vậy HCl dư bài toán tính theo lượng Fe.
\(n_{FeCl_2}=n_{H_2}=n_{Fe}=0,1\left(mol\right)\\ m_{FeCl_2}=0,1.127=12,7\left(g\right)\\ m_{H_2}=0,1.2=0,2\left(g\right)\\ m_{\text{dd sau phản ứng}}=5,6+300-0,2=305,4\left(g\right)\\ C\%_{\text{dd sau phản ứng}}=\dfrac{12,7}{305,4}.100\%=4,158\%\)
Đúng 0
Bình luận (1)
hòa tan 5,6g Fe vào 200g hcl 3,65 %. tính C% dd mới.
mọi người giúp em với ạ. Hóa 8,9 đó ạ!!Hòa tan 5,6g Fe bằng 50g dd HCL 18,25%. Sau phản ứng thu được dd X. Cho toàn bộ dd X ở trên tác dụng vừa đủ với 44,6g dd Na2Co3 thu được dd T. Tính C% các chất tan trong dd T
Hòa tan hoàn toàn 8g MgO vào 200 g dd HCl vừa đủ tạo dd A.a)Tính C% của dd HCl đã dùng. b)Tính C% của dd tạo thành sau phản ứng.c)Nếu đem hòa tan lượng MgO ở trên trong 300g dung dịch HCl 7,3%. Tìm C% của các chất có trong dung dịch A.Hòa tan hoàn toàn 8g MgO vào 200 g dd HCl vừa đủ tạo dd A.a)Tính C% của dd HCl đã dùng. b)Tính C% của dd tạo thành sau phản ứng.c)Nếu đem hòa tan lượng MgO ở trên trong 300g dung dịch HCl 7,3%. Tìm C% của các chất có trong dung dịch A.
Đọc tiếp
Hòa tan hoàn toàn 8g MgO vào 200 g dd HCl vừa đủ tạo dd A.
a)Tính C% của dd HCl đã dùng. b)Tính C% của dd tạo thành sau phản ứng.
c)Nếu đem hòa tan lượng MgO ở trên trong 300g dung dịch HCl 7,3%. Tìm C% của các chất có trong dung dịch A.Hòa tan hoàn toàn 8g MgO vào 200 g dd HCl vừa đủ tạo dd A.
a)Tính C% của dd HCl đã dùng. b)Tính C% của dd tạo thành sau phản ứng.
c)Nếu đem hòa tan lượng MgO ở trên trong 300g dung dịch HCl 7,3%. Tìm C% của các chất có trong dung dịch A.
Hòa tan hoàn toàn 5,6g sắt vào dd HCL 1M hãy a tính thể tích khí h2 tạo ra ở đktc b tính thể tích dd hcl C khối lượng fecl2 . Gọi tên
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,1 0,2 0,1 0,1
\(a,V_{H_2}=0,1.22,4=2,24\left(l\right)\)
\(b,V_{HCl}=\dfrac{n}{C_M}=\dfrac{0,2}{1}=0,2\left(l\right)\)
\(c,m_{FeCl_2}=0,1.127=12,7\left(g\right)\)
Tên gọi : Sắt (II) Clorua
Đúng 2
Bình luận (0)
hòa tan hoàn toàn mg vào đủ trong 200g dd HCl 3,65%.
a)Tính VH2 sinh ra.
b)Tính mMg tham gia PỨ
\(n_{HCl}=200.3,65\%=7,3g\)
\(m_{HCl}=\dfrac{7,3}{36,5}=0,2mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 0,2 0,1 ( mol )
\(m_{Mg}=0,1.24=2,4g\)
\(V_{H_2}=0,1.22,4=2,24l\)
Đúng 3
Bình luận (0)
\(m_{HCl}=200.3,65\%=7,3\left(g\right)\\
n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\\ pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 0,2 0,1
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\\
m_{Mg}=0,1.24=2,4\left(g\right)\)
Đúng 1
Bình luận (0)
Mg + 2HCl -- > MgCl2 + H2
mHCl = (200.3,65) / 100 = 7,3(g)
=> nHCl = 7,3 : 36,5 = 0,2 (mol)
=> nH2 = 0,1 (mol)
=> VH2 = 0,1 .22,4 = 2,24(l)
nMg = nHCl = 0,2(mol)
mMg = 0,1 . 24 = 2,4(g)
Đúng 0
Bình luận (1)
1.Hòa tan 4g ZnO vào 150g dd HCl 3,65%.Tính C% dd thu được sau phản ứng
2.Cho 15,3g oxit của kim loại hóa trị II vào nước thu đc dd bazo nồng độ 8,55%.Xác định công thức oxit trên
Hoà tan 5,6g Fe trong dd HCl 0,5M vừa đủ, tính thể tích dd HCl cần sử dụng?
\(n_{Fe}=\dfrac{5,6}{56}=0,1(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow n_{HCl}=2n_{Fe}=0,2(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,2}{0,5}=0,4(l)\)
Đúng 0
Bình luận (0)
Bảo toàn nguyên tố Cl, Fe:
\(n_{HCl}=2n_{FeCl_2}=2n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow V=0,4\left(l\right)\)
Đúng 0
Bình luận (0)
Hoà tan 5,6g Fe trong dd 300ml dd HCl 1M, tính thể tích H2 (dktc) thu được?
\(n_{Fe}=\dfrac{5,6}{56}=0,1(mol);n_{HCl}=1.0,3=0,3(mol)\\ Fe+2HCl\to FeCl_2+H_2\\ \)
Vì \(\dfrac{n_{Fe}}{1}<\dfrac{n_{HCl}}{2}\) nên HCl dư
Do đó \(n_{H_2}=n_{Fe}=0,1(mol)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24(l)\)
Đúng 2
Bình luận (0)