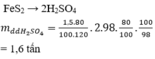từ 12 tấn FeS2 điều chế dd axit H2SO4 98%. Tính khối lượng dd axit thu được (H=80%)

Những câu hỏi liên quan
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch
H
2
S
O
4
98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80%
F
e
S
2
(hiệu suất toàn quá trình là 80%) là A. 0,80 tấn B. 1,60 tấn C. 1,25 tấn D. 2,00 tấn
Đọc tiếp
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch H 2 S O 4 98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% F e S 2 (hiệu suất toàn quá trình là 80%) là
A. 0,80 tấn
B. 1,60 tấn
C. 1,25 tấn
D. 2,00 tấn
Câu 1. Dùng 100 tấn quặng pirit sắt chứa 72% FeS2 để điều chế H2SO4. Cho toàn bộ axit thu được tác dụng vs Cu điều chế CuSO4.5H2O sau đó pha thành dd CuSO4 để trừ nấm thực vật. Tính m (tấn) CuSO4.5H2O thu được. biết hiệu suất cả quá trình là 80%.
9. Trong công nghiệp điều chế H2SO4 từ FeS2 theo sơ đồ sau: FeS2 SO2 SO3 H2SO4 a) Viết phương trình phản ứng và ghi rõ điều kiện. b) Tính lượng axit H2SO4 điều chế được từ 1 tấn quặng chứa 60% FeS2. Biết H% của quá trình là 80%.
a)
$4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2$
$2SO_2 + O_2 \xrightarrow{t^o,xt} 2SO_3$
$SO_3 + H_2O \to H_2SO_4$
b)
$m_{FeS_2} = 1000.60\% = 600(kg)$
$n_{FeS_2} = \dfrac{600}{120} = 5(kmol)$
$n_{FeS_2\ pư} = 5.80\% = 4(kmol)$
$n_{H_2SO_4} = 2n_{FeS_2} = 8(kmol)$
$m_{H_2SO_4} = 8.98 = 784(kg)$
Đúng 1
Bình luận (0)
4FeS2+11O2to→2Fe2O3+8SO2
4FeS2+11O2→to2Fe2O3+8SO2
2SO2+O2to,xt−−→2SO3
2SO2+O2→to,xt2SO3
SO3+H2O→H2SO4
SO3+H2O→H2SO4
b)
mFeS2=1000.60%=600(kg)
mFeS2=1000.60%=600(kg)
nFeS2=600120=5(kmol)
nFeS2 pư=5.80%=4(kmol)
nFeS2 pư=5.80%=4(kmol)
nH2SO4=2nFeS2=8(kmol)
nH2SO4=2nFeS2=8(kmol)
mH2SO4=8.98=784(kg)
Đúng 0
Bình luận (0)
Trong công nghiệp, axit sunfuric được điều chế từ quang pirit sắt. Khối lượng H2SO4 điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% FeS2 ( hiệu suất toàn quá trình là 80%) là:
A. 1,568 tấn
B. 1,96 tấn
C. 1,25 tấn
D. 2,00 tấn
Đáp án A.
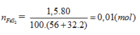
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
Đúng 0
Bình luận (0)
tính khối lượng sắt pirit (FeS2) cần dùng để điều chế 49 tấn dd h2so4 98% biết hiệu suất toàn quấ trình là 78%
4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
SO2 + O2 --to--> SO3
SO3 + H2O --> H2SO4
Theo phương trình, cứ 1 mol FeS2 thì tạo ra 2 mol H2SO4
=> cứ 0,245 mol FeS2 thì tạo ra 0,49 mol H2SO4
=> cứ 29,4g FeS2 thì tạo ra 48,02g H2SO4
=> cứ 29,4g FeS2 thì tạo ra 49g dd H2SO4 98%
=> cứ 29,4 tấn FeS2 thì tạo ra 49 tấn dd H2SO4 98%
Do hiệu suất của quá trình là 78%
=> mFeS2 (thực tế) = \(\dfrac{29,4.100}{78}=37,692\left(tấn\right)\)
Đúng 0
Bình luận (0)
trong công nghiệp người ta điều chế H2SO4 từ quặng pirit sắt có thành phần chính là FeS2 theo sơ đồ sau FeS2->SO2->SO3->H2SO4.tính khối lượng H2SO4 98% điều chế được từ 1 tấn quặng chứa 60% FeS2 .Biết hiệu của cả quá trình là 80%
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)
Đúng 1
Bình luận (2)
\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
Đúng 1
Bình luận (0)
Tính lượng Axit 98% điều chế được 1 tấn quặng chứa 60% FeS2. Biết hiệu suất của quá trình là 80%.
Ta có: $m_{FeS_2}=600(kg)\Rightarrow n_{FeS_2}=5000(mol)$
Bảo toàn S với hiệu suất 80% ta có: $n_{H_2SO_4}=5000.2.80\%=8000(mol)$
$\Rightarrow m_{ddH_2SO_4}=800(kg)$
Đúng 3
Bình luận (4)
1 tấn = 1000 kg
$m_{FeS_2} = 1000.60\% = 600(kg)$
$n_{FeS_2} = \dfrac{600}{120} = 5(kmol)$
$n_{FeS_2\ pư} = 5.80\% = 4(kmol)$
Bảo toàn S :
$n_{H_2SO_4} = 2n_{FeS_2} = 8(kmol)$
$m_{dd\ H_2SO_4} = \dfrac{8.98}{98\%} =800(kg)$
Đúng 1
Bình luận (6)
Cho 200 ml dd H2SO4 3M vào trong 350 ml dd BaCl2 2M%. a) Tính khối lượng kết tủa thu được
b) Tính CM các chất có trong dung dịch sau phản ứng.
c) Để có được lượng axit sunfuric như trên cần dùng bao nhiêu gam FeS2 điều chế biết rằng hiệu suất của cả quá trình phản ứng là 75%
giúp mình với ạaa
a,\(n_{H_2SO_4}=0,2.3=0,6\left(mol\right);n_{BaCl_2}=0,35.2=0,7\left(mol\right)\)
PTHH: H2SO4 + BaCl2 → BaSO4 ↓ + 2HCl
Mol: 0,6 0,6 0,6 0,12
Ta có: \(\dfrac{0,6}{1}< \dfrac{0,7}{1}\)⇒ H2SO4 hết, BaCl2 dư
\(m_{BaSO_4}=0,6.233=139,8\left(g\right)\)
b,Vdd sau pứ = 0,2+0,35 = 0,55 (l)
\(C_{M_{HCl}}=\dfrac{0,6}{0,55}=\dfrac{12}{11}M\)
\(C_{M_{BaCl_2dư}}=\dfrac{0,7-0,6}{0,55}=\dfrac{2}{11}M\)
c,\(m_{H_2SO_4\left(lt\right)}=0,6.98=58,8\left(g\right)\Rightarrow m_{H_2SO_4\left(pứ\right)}=\dfrac{58,8}{75\%}=78,4\left(g\right)\)
\(n_{H_2SO_4}=\dfrac{78,4}{98}=0,8\left(mol\right)\)
PTHH: 3FeS2 + 6H2O + 11O2 → Fe3O4 + 6H2SO4
Mol: 0,4 0,8
\(m_{FeS_2\left(lt\right)}=0,8.120=96\left(g\right)\)
Đúng 0
Bình luận (3)
Trong công nghiệp , người ta điều chế axit sunfuric H2SO4 từ quặng pirit sắt theo sơ đồ sau : FeS2 ---- SO2 ---- SO3 ----- H2SO4
a) Viết các phương trình cho dãy P/Ư
b) Nếu dùng 1 tấn quặng có chứa 60% FeS2 thì điều chế đc bao nhiêu lg axit 98% .Biết H80%
c) Muốn điều chế 100g axit 98% vs H như trên thì khối lg quặng cần dùng là bao nhiêu .
, người ta điều chế
Đọc tiếp
Trong công nghiệp , người ta điều chế axit sunfuric H2SO4 từ quặng pirit sắt theo sơ đồ sau : FeS2 ----> SO2 ----> SO3 -----> H2SO4
a) Viết các phương trình cho dãy P/Ư
b) Nếu dùng 1 tấn quặng có chứa 60% FeS2 thì điều chế đc bao nhiêu lg axit 98% .Biết H=80%
c) Muốn điều chế 100g axit 98% vs H như trên thì khối lg quặng cần dùng là bao nhiêu .
, người ta điều chế