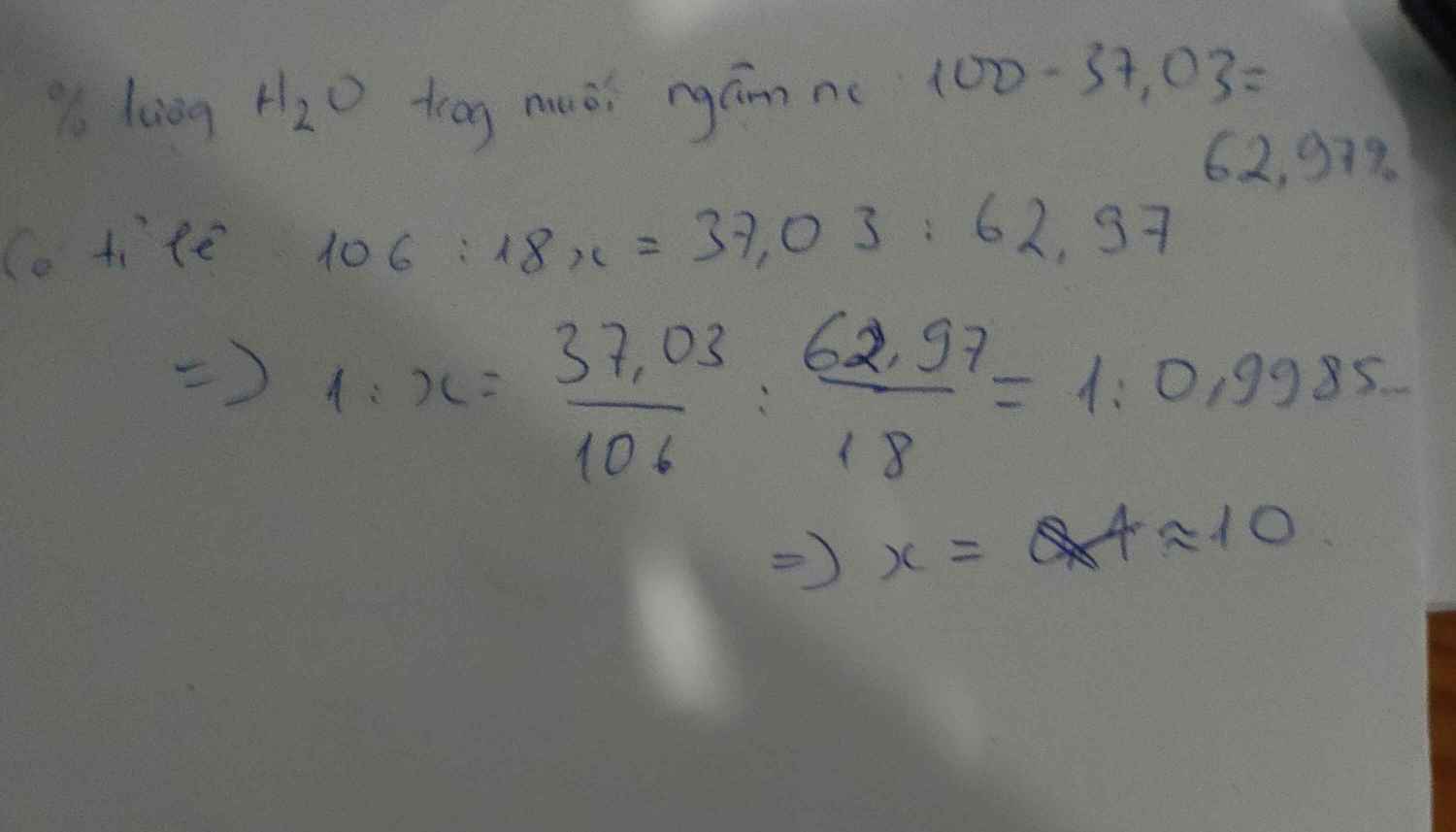Tìm X trong công thức Na2CO3.xH2O. Biết trong muối ngậm nước Na2CO3 chiếm 37,07% về khối lượng

Những câu hỏi liên quan
tìm x trong CT Na2CO3.xH2O. Biết rằng trog muối ngậm nước đó thì Na2CO3 chiêm 37,07%
=> %mH2O = 100% - 37,07% = 62,93%
=> mH2O = \(\frac{18x}{23.2+12+16.3+18x}.100\%=62,93\%\)
=> x = 10
=> CTHH: Na2CO3 . 10H2O
Đúng 1
Bình luận (1)
Bài 1:Tìm x,y trong công thức x.CuSO4.yH2O, biết trong phân tử muối ngậm nước này CuSO4 chiếm 47,05% về khối lượng
Bài 2: Tìm x trong công thức Na2CO3.x.H2O, biết trong phân tử muối ngậm nước này Na2CO3 chiếm 37,07% veed khối lượng
Giúp mình với mình cần gấp !! huhu
1.
=>\(\%m_{CuSO_4}=\dfrac{160x}{160x+18y}.100=47,05\%\)
=>16000x=7528x+846,9y
=>8472x=846,9y
=>10x=y
=>\(\dfrac{x}{y}=\dfrac{1}{10}\)
=>CTHH :\(CuSO_4.10H_2O\) (ct này có vấn đề )
Đúng 0
Bình luận (0)
cho ct muối có dạng na2co3 .ah2o . biết trong muối ngậm nước , na2co3 chiếm 37,03% theo khối lượng.xđ gt của A
=> %mH2O = 100% - 37,03% = 62,97%
=> mH2O = \(\dfrac{18a}{23.2+12+16.3+18a}.100\%=62.97\%\)
=> x = 10
=> CTHH: Na2CO3 . 10H2O
Đúng 2
Bình luận (1)
4. Hoà tan hoàn toàn 2,86 gam Na2CO3.xH2O vào nước. Ta thu được 100ml dung dịch Na2CO3 0,1M. Xác định CTPT của muối ngậm nước trên.
`m_[H_2 O]=2,86-0,1.0,1.106=1,8(g)`
`=>n_[H_2 O]=[1,8]/18=0,1(mol)`
`=>x=[0,1]/[0,1.0,1]=10`
`=>CTPT` của muối ngậm nước là: `Na_2 CO_3 .10H_2 O`
Đúng 1
Bình luận (0)
Bài 18: Oxi hoá hoàn toàn một lượng chất B cần 448 ml O2 (đktc) và chỉ thu được 448ml CO2 (đktc) và 0,36 g H2O. Khối lượng riêng B ở đktc là 2,679 g/dm3. Tìm công thức của B.
Bài 19: Đốt cháy hoàn toàn x gam chất A chỉ thu được a gam CO2 và b g H2O. Biết 3a 11b và 7x 3(a+b). Tỉ khối hơi của A so với không khí 3. Tìm công thức của A.
Bài 20: Cho X và Y là 2 oxit của cùng một kim loại M. Biết khi hoà tan cùng một lượng oxit X như nhau đến hoàn toàn trong HNO3 và HCl rồi cô cạn dung dịch t...
Đọc tiếp
Bài 18: Oxi hoá hoàn toàn một lượng chất B cần 448 ml O2 (đktc) và chỉ thu được 448ml CO2 (đktc) và 0,36 g H2O. Khối lượng riêng B ở đktc là 2,679 g/dm3. Tìm công thức của B.
Bài 19: Đốt cháy hoàn toàn x gam chất A chỉ thu được a gam CO2 và b g H2O. Biết 3a = 11b và 7x = 3(a+b). Tỉ khối hơi của A so với không khí < 3. Tìm công thức của A.
Bài 20: Cho X và Y là 2 oxit của cùng một kim loại M. Biết khi hoà tan cùng một lượng oxit X như nhau đến hoàn toàn trong HNO3 và HCl rồi cô cạn dung dịch thì thu được những lượng muối nitrat và clorua của kim loại M có cùng hoá trị. Ngoài ra, khối lượng muối nitrat khan lớn hơn khối lượng muối clorua khan một lượng bằng 99,38% khối lượng oxit đem hoà tan trong mỗi axit. Phân tử khối của oxit Y bằng 45% phân tử khối của oxit X. Xác định các oxit X, Y.
Bài 21: Trong muối ngậm nước Na2CO3.xH2O, Na2CO3 chiếm 37,07% về khối lượng. Tìm công thức muối.
3.Hoà tan 43,8 gam CaCl2.xH2O vào 156,2 gam H2O. Ta thu được dung dịch CaCl2 11,1%. Xác định CTPT của muối ngậm nước trên 4. Hoà tan hoàn toàn 2,86 gam Na2CO3.xH2O vào nước. Ta thu được 100ml dung dịch Na2CO3 0,1M. Xác định CTPT của muối ngậm nước trên.
3.
- Ta có: m dd CaCl2 = 43,8 + 156,2 = 200 (g)
Mà: C%CaCl2 = 11,1%
\(\Rightarrow\dfrac{m_{CaCl_2}}{m_{ddCaCl_2}}=0,111\) \(\Rightarrow m_{CaCl_2}=22,2\left(g\right)\) \(\Rightarrow n_{CaCl_2}=\dfrac{22,2}{111}=0,2\left(mol\right)\)
Có: \(n_{CaCl_2}=n_{CaCl_2.xH_2O}=\dfrac{43,8}{111+18x}=0,2\left(mol\right)\)
⇒ x = 6
Vậy: CTPT cần tìm là CaCl2.6H2O
- Ta có: \(n_{Na_2CO_3.xH_2O}=n_{Na_2CO_3}=0,1.0,1=0,01\left(mol\right)\)
\(\Rightarrow\dfrac{2,86}{106+18x}=0,01\)
⇒ x = 10
Vậy: CTPT cần tìm là Na2CO3.10H2O.
Đúng 2
Bình luận (0)
Bài 1: Hỗn hợp A gồm H2, H2S và SO2 có tỷ lệ mol 1:2:3. Trộn A vs oxi dư. Giả thiết pư hoàn toàn nlamf lạnh hỗn hợp thu được chất Y duy nhất. xác định Y
Bài 1 Tính lượng sắt có trong 1 tấn quặng sắt manhetit biết chứa 81,2%Fe3O4
Bài 2 Tìm x trong công thức Na2CO3.xH2O. Biết muối ngậm nước đó chứa 37,07% khối lượng
Bài 3: hỗn hợp khí gồm NO, NO2 và NxOy có tp thể tích là 45%NO, 15% NO2, còn là NxOy. Ttong hỗn hợp có 23,6% lượng NO và còn lại là NxOy có 69,6% khối lượng Oxo. Tìm NxOy
Đọc tiếp
Bài 1: Hỗn hợp A gồm H2, H2S và SO2 có tỷ lệ mol 1:2:3. Trộn A vs oxi dư. Giả thiết pư hoàn toàn nlamf lạnh hỗn hợp thu được chất Y duy nhất. xác định Y
Bài 1 Tính lượng sắt có trong 1 tấn quặng sắt manhetit biết chứa 81,2%Fe3O4
Bài 2 Tìm x trong công thức Na2CO3.xH2O. Biết muối ngậm nước đó chứa 37,07% khối lượng
Bài 3: hỗn hợp khí gồm NO, NO2 và NxOy có tp thể tích là 45%NO, 15% NO2, còn là NxOy. Ttong hỗn hợp có 23,6% lượng NO và còn lại là NxOy có 69,6% khối lượng Oxo. Tìm NxOy
Bài 2
MNa2CO3.xH2O = 106+18x
Vì % MNa2CO3 = 37,07% =106 (g/mol)
=> \(\dfrac{106}{106+18x}=37,07\%\)
<=> 106=39,2942+6,6726x
<=> x \(\approx10\)
Vậy x=10
Đúng 0
Bình luận (0)
Bài 1 :
PTHH:
\(A+O_{2\left(dư\right)}-->H_2SO_4.n_{SO_3}\)
Vì hỗn hợp A gồm H2, H2S và SO2 có tỷ lệ mol 1:2:3 .
Gỉa sử số mol các chất đó là \(x;2x;3x\)
\(=>n_H=6x;n_S=5x\)
Ta có, theo công thức Oleum :
\(n_H:n_S=2:\left(x+1\right)=6x:5x\)
\(=>x=\dfrac{2}{3}\)
Vậy Y là \(3H_2SO_4.2SO_3\)
Đúng 0
Bình luận (0)
Bài 1 (*) :
Lượng sắt có trong một tấn quặng sắt manhetit :
\(1.81,2\%\) = 0,812 (tấn ) = 812(g)
\(\%m_{Fe}=\dfrac{3.56.100\%}{232}=72,414\%\)
\(=>m_{Fe}=812.72,414\%=588\left(g\right)\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Một muối ngậm nước có công thức là MgX2.nH2O (X là nguyên tố chưa biết, n là số tự nhiên; 5 ≤ n ≤ 8). Biết %Mg = 11,82%.
a/ Hãy xác định công thức hóa học của muối ngậm nước trên.
b/ Tính % khối lượng của X trong tinh thể.
c/ Tính khối lượng H3PO4 có chứa lượng H bằng lượng H có trong 40,6 gam tinh thể trên
a) \(\%Mg=\dfrac{24}{24+2.M_X+18n}.100\%=11,82\%\)
=> MX + 9n = 89,523
Xét n = 5 => MX = 44,5 (Loại)
Xét n = 6 => MX = 35,5 => X là Cl
Xét n = 7 => MX = 26,5 (Loại)
Xét n = 8 => MX = 17,5 (loại)
Vậy CTHH của tinh thể là MgCl2.6H2O
b) \(\%Cl=\dfrac{35,5.2}{203}.100\%=34,975\%\)
c) \(n_{MgCl_2.6H_2O}=\dfrac{40,6}{203}=0,02\left(mol\right)\)
=> nH = 0,02.12 = 0,24 (mol)
=> \(n_{H_3PO_4}=\dfrac{0,24}{3}=0,08\left(mol\right)\)
=> mH3PO4 = 0,08.98 = 7,84 (g)
Đúng 4
Bình luận (0)
Trong muối ngậm nước FeSO4.nH2O, phần trăm về khối lượng của Fe là 20,144%. Tình công thức hoá học của muối ngậm nước
có mFe/Mx=0.20144
\(\Rightarrow\) Mx=278 rồi tính được n=7
ct FeSO4.7H20
Đúng 0
Bình luận (0)