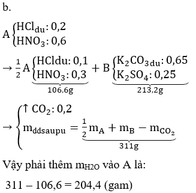
Có hai cốc thuỷ tinh có khối lượng bằng nhau. Cho dung dịch H2So4 loãng vào cốc thứ nhất( cốc A), cho dung dịch HCl vào cốc thứ hai( cốc B). Đặt hai cốc A và B lên 2 đĩa cân ( cân robecvan - cân 2 đĩa) thì cân ở vị trí cân bằng. Sau đó tiến hành hai thí nghiệm:
- Thí nghiệm 1: Cho 4,8 gam Mg vào cốc A.
- Thí nghiệm 2: Cho m gam MgCo3 vào cốc B, phương trình hoá học xảy ra như sau:
MgCO3 + 2HCl -------> MgCl2 + CO2 + H2O
Khi cả Mg và MgCO3 đều tan hoàn toàn thấy cân ở vị trí thăng bằng. Tính m ?
Mn gửi cả lời giải giúp mình với ......thanks tr