Hợp chất Y có thành phần % theo khối lượng các nguyên tố là: %Na= 28% ; %Al= 33% . Còn lại là % của O. Biết phân tử khối của Y = 82(đvC). Xác định công thức hóa học của Y

Những câu hỏi liên quan
CTHH của hợp chất Y có dạng là NaxNyOz. Thành phần phần trăm theo khối lượng các nguyên tố Y như sau: 27,06% Na; 16,47% N và 56,47% O. xác định CTHH của Y, biết khối lượng mol của Y là 85g/mol
nêu các bước giải bài toán xác định CTHH của hợp chất khi biết thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất
B1 : Tìm khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
B2 : Tìm số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
B3 : Lập CTHH.
Đúng 0
Bình luận (1)
còn xác định công thức hóa hc của Y nữa mà bn
Đúng 0
Bình luận (4)
Bước 1: Tìm khối lượng mol của nguyên tố có trong 1 mol hợp chất.
Bước 2: Tìm số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
Bước 3: Lập CTHH của hợp chất.
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Hợp chất a có khối lượng mol là 58,5 gam/mol A: thành phần các nguyên tố theo khối lượng lần lượt là 39,32% Na và 60,68% Cl B: hợp chất b có khối lượng mol là 106 g/mol hành phần các nguyên tố theo khối lượng lần lượt là 43,4% Na, 11,3% c 45,3% O C: hợp chất c có khối lượng mol là 80g/mol thành phần các nguyên tố theo khối lượng lần lượt là 80% Cu và 20%O
Hãy tìm công thức hoá học của những hợp chất có thành phần các nguyên tố như sau : a, Hợp chất A có khối lượng mol phần tử là 58,5g/mol , thành phần các nguyên tố theo khối lượng : 60,68% CI và còn lại là Na. b, Hợp chất B có khối lượng mol phần tử là 106g/mol , thành phần các nguyên tố theo khối lượng : 43,4% Na ; 11,3% C và 45,3%O
b. Ta có: \(\%_{Na}=100\%-60,68\%=39,32\%\)
Gọi CTĐG của A là: NaxCly
Ta lại có: \(\dfrac{x}{y}=\dfrac{\dfrac{39,32\%}{23}}{\dfrac{60,68\%}{35,5}}\approx\dfrac{1,7}{1,7}=\dfrac{1}{1}\Leftrightarrow\left\{{}\begin{matrix}x=1\\y=1\end{matrix}\right.\)
Gọi CTHH của A là: \(\left(NaCl\right)_n\)
Theo đề, ta có: \(M_{\left(NaCl\right)_n}=\left(23+35,5\right).n=58,5\)(g/mol)
\(\Leftrightarrow n=1\)
Vậy CTHH của A là NaCl
b. Gọi CTĐG của B là: \(Na_aC_bO_c\)
Ta có: \(x:y:z=\dfrac{43,4\%}{23}:\dfrac{11,3\%}{12}:\dfrac{45,3\%}{16}\approx1,9:0,9:2,8\approx2:1:3\)
Gọi CTHH của B là: \(\left(Na_2CO_3\right)_t\)
Theo đề, ta có: \(M_{\left(Na_2CO_3\right)_t}=\left(23.2+12+16.3\right).t=106\)(g/mol)
\(\Leftrightarrow t=1\)
Vậy CTHH của B là Na2CO3
Đúng 2
Bình luận (1)
tìm CTHH của hợp chất, biết:a/ khối lượng mol của hợp chất A là 142 gam,thành phần phần trăm theo khối lượng của các nguyên tố: 32,39%Na;22,54%S;45,07%Ob/ khối lượng mol của hợp chất B là 123 gam, thành phần phần trăm theo khối lượng của các nguyên tố: 58,5%C;4,1%H;11,4%N;26%Oc/ hợp chất C có khối lượng mol nặng gấp 23 lần khí hidro, thành phần phần trăm theo khối lượng của các nguyên tố: 52,17%C; 13,05%H; 34,74%O
Đọc tiếp
tìm CTHH của hợp chất, biết:
a/ khối lượng mol của hợp chất A là 142 gam,thành phần phần trăm theo khối lượng của các nguyên tố: 32,39%Na;22,54%S;45,07%O
b/ khối lượng mol của hợp chất B là 123 gam, thành phần phần trăm theo khối lượng của các nguyên tố: 58,5%C;4,1%H;11,4%N;26%O
c/ hợp chất C có khối lượng mol nặng gấp 23 lần khí hidro, thành phần phần trăm theo khối lượng của các nguyên tố: 52,17%C; 13,05%H; 34,74%O
a)
-Đặt công thức: NaxSyOz
x=\(\dfrac{32,29.142}{23.100}\approx2\)
y=\(\dfrac{22,54.142}{32.100}\approx1\)
z=\(\dfrac{45,07.142}{16.100}\approx4\)
-CTHH: Na2SO4
Đúng 1
Bình luận (0)
Câu b này mình giải cách khác câu a:
nC:nH:nN:nO=\(\dfrac{\%C}{12}:\dfrac{\%H}{1}:\dfrac{\%N}{14}:\dfrac{\%O}{16}=\dfrac{58,5}{12}:\dfrac{4,1}{1}:\dfrac{11,4}{14}:\dfrac{26}{16}\)
nC:nH:nN:nO=4,875:4,1:0,81:1,625=6:5:1:2
-Công thức nguyên: (C6H5NO2)n
-Ta có: (12.6+5+14+16.2)n=123\(\Leftrightarrow\)123n=123\(\Leftrightarrow\)n=1
-CTHH: C6H5NO2
Đúng 1
Bình luận (0)
Câu c:
\(M_C=23.2=46đvC\)
nC:nH:nO=\(\dfrac{\%C}{12}:\dfrac{\%H}{1}:\dfrac{\%O}{16}=\dfrac{52,17}{12}:\dfrac{13,05}{1}:\dfrac{34,74}{16}\)
nC:nH:nO=4,3475:13,05:2,17125\(\approx\)2:6:1
-Công thức nguyên: (C2H6O)n
-Ta có: (12.2+6+16)n=46\(\Leftrightarrow\)46n=46\(\Leftrightarrow\)n=1
-CTHH: C2H6O
Đúng 1
Bình luận (0)
Tìm công thức hóa học của các hợp chất có thành phần các nguyên tố sau
1) hợp chất A có khối lượng mol là 106 gam / mol thành phần các nguyên tố theo khối lượng : 43,4% Na ; 11,3% C và 45,3% O
2) hợp chất B có thành phần các nguyên tố là : 60,68% Cl và còn lại là Na biết hợp chất B có khối lượng mol phân tử là 80g/mol oxít
Câu 25: a) Hợp chất X chứa 94,12% lưu huỳnh, còn lại là hiđro. Hãy lập công thức hoá học của
hợp chất trên và cho biết ý nghĩa của công thức hoá học đó.
b) Hợp chất Y có thành phần phần trăm theo khối lượng các nguyên tố lần lượt là: 28% Na, 33%Al
và 39%O. Xác định công thức hoá học của hợp chất Y.
a) CTHH: \(H_xS\)
Ta có : \(\dfrac{32}{x+32}=94,12\%\Rightarrow x=2\)
=> CTHH: \(H_2S\)
Ý nghĩa : hợp chất được tạo từ 2 nguyên tố H, S
Trong 1 phân tử chất có 1 nguyên tử H và 2 nguyên tử S
Phân tử khối của hợp chất là 2 + 32 = 34 đvC
b) Gọi CTHH của hợp chất là \(Na_xAl_yO_z\)
Ta có : \(x:y:z=\dfrac{28}{23}:\dfrac{33}{27}:\dfrac{39}{16}=1:1:2\)
Vậy CTHH của hợp chất là \(NaAlO_2\)
Đúng 1
Bình luận (1)
Câu 25: a) Hợp chất X chứa 94,12% lưu huỳnh, còn lại là hiđro. Hãy lập công thức hoá học của hợp chất trên và cho biết ý nghĩa của công thức hoá học đó.
b) Hợp chất Y có thành phần phần trăm theo khối lượng các nguyên tố lần lượt là: 28% Na, 33%Al và 39%O. Xác định công thức hoá học của hợp chất Y.
a) CTHH: HxS
Ta có : =94,12%⇒x=2
=> CTHH: H2S
Ý nghĩa : hợp chất được tạo từ 2 nguyên tố H, S
Trong 1 phân tử chất có 1 nguyên tử H và 2 nguyên tử S
Phân tử khối của hợp chất là 2 + 32 = 34 đvC
b) Gọi CTHH của hợp chất là NaxAlyOz
Ta có :
Đúng 0
Bình luận (1)
hãy tìm công thức hóa học của những hợp chất có thành phần các nguyên tố như sau
hợp chất A có khối lượng mol phân tử là 58,5 gam/mol thành phần các nguyên tố theo khối lượng 43,3% Na ; 11,3% C và còn lại là O
hợp chất B có khối lượng mol phân tử là 106 gam/mol thành phần các nguyên tố theo khối lượng 60,68% Cl và còn lại là Na
Hợp chất A:
- Khối lượng của từng nguyên tố là:
\(m_{Na}=\dfrac{58,5\text{x}43,3}{100}=25\left(g\right)\)
\(m_C=\dfrac{58,5x11,3}{100}=7\left(g\right)\)
\(m_O=58,5-25-7=26,5\left(g\right)\)
- Số mol của từng nguyên tố là:
\(n_{Na}=\dfrac{25}{23}=1\left(mol\right)\)
\(n_C=\dfrac{7}{12}=1\left(mol\right)\)
\(n_O=\dfrac{26,5}{16}=2\left(mol\right)\)
Vậy: Công thức hoá học của hợp chất A là \(NaCO_2\)
- Hợp chất B:
- Khối lượng của từng nguyên tố:
\(m_{Cl}=\dfrac{60,68\text{x}106}{100}=64\left(g\right)\)
\(m_{Na}=106-64=42\left(g\right)\)
- Số mol của từng nguyên tố là:
\(n_{Cl}=\dfrac{64}{35,5}=2\left(mol\right)\)
\(n_{Na}=\dfrac{42}{23}=2\left(mol\right)\)
Vậy: Công thức hoá học của hợp chất B là \(Na_2Cl_2\)
Đúng 0
Bình luận (0)
Hợp chất A có khối lượng mol phân tử là 106 g/mol,thành phần các nguyên tố theo khối lượng:43,4%Na,11,3%Cvà 45,3%O.Tìm CTHH của hợp chất A
Hãy tìm công thức hóa học của những hợp chất có thành phần các nguyên tố như sau:
a) Hợp chất A có khối lượng mol phân tử là 58,5g có thành phần các nguyên tố 60,68% Cl và còn lại là Na.
b) Hợp chất B có khối lượng mol phân tử là 106g, thành phần 43,4% Na 11,3% C và 45,3% O.
a) %Cl = 60,68%
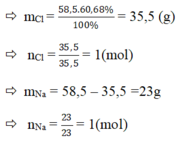
Vậy trong 1 phân tử hợp chất A có : 1 nguyên tử Na, 1 nguyên tử Cl.
⇒ CTHH của hợp chất A : NaCl
b)
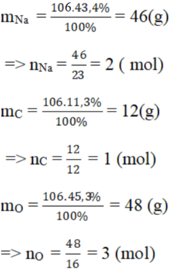
Vậy trong 1 phân tử hợp chất B có: 2 nguyên tử Na, 1 nguyên tử C, 3 nguyên tử O.
⇒ CTHH của hợp chất B : Na2CO3.
Đúng 3
Bình luận (0)
































