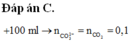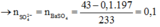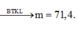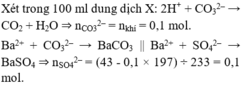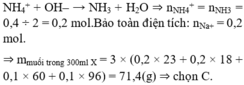Cho dung dịch Ba(OH )2 tác dụng với 100 ml dung dịch HCl 2M ( D = 1,92 g / ml ) tính C% BaCl2 sau phản ứng

Những câu hỏi liên quan
cho 100ml dung dịch HCl 2M tác dụng với dung dịch Ba(OH)2 0,2M
a) thể tích của dung dịch Ba(OH)2 0,2M phản ứng
b) tính CM của dd BaCl2 thu được sau phản ứng
100ml = 0,1l
Số mol của HCL là :
\(C_M=\dfrac{n}{V}=>n=C_M.V=2.0,1=0,2\left(mol\right)\)
Phương trình phản ứng là :
\(2HCL+Ba\left(OH\right)_2->BaCl_2+2H_2O\)
Số mol của \(Ba\left(OH\right)_2\) là :
\(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{HCL}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
\(n_{BaCl_2}=\dfrac{1}{2}n_{HCL}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
a) Thể tích dung dịch \(Ba\left(OH\right)_2\) là :
\(C_M=\dfrac{n}{V}=>V=\dfrac{n}{C_M}=\dfrac{0,1}{0,2}=0,5\left(l\right)\)
b) Thể tích của \(BaCl_2\) (đktc) là :
\(V_{BaCl_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
Nồng động dung dịch của \(BaCl_2\) là :
\(C_M=\dfrac{n}{V}=\dfrac{0,1}{2,24}=0,446M\)
Đúng 0
Bình luận (0)
Cho 100 ml dung dịch H2SO4 2M ( D = 1,2 g/m) tác dụng với 100 ml dung dịch BaCl2 1m ( D = 1,32 g/ml )
a) Tính khối lượng chất kết tủa tạo thành
b) Tính nồng độ phần trăm và nồng độ mol của dung dịch tạo thành
\(n_{H_2SO_4}=0.1\cdot2=0.2\left(mol\right)\)
\(m_{dd_{H_2SO_4}}=100\cdot1.2=120\left(g\right)\)
\(n_{BaCl_2}=0.1\cdot1=0.1\left(mol\right)\)
\(m_{dd_{BaCl_2}}=100\cdot1.32=132\left(g\right)\)
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
\(0.1................0.1.........0.1...............0.2\)
\(\Rightarrow H_2SO_4dư\)
\(m_{BaSO_4}=0.1\cdot233=23.3\left(g\right)\)
\(V_{dd}=0.1+0.1=0.2\left(l\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.2-0.1}{0.2}=0.5\left(M\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.2}=1\left(M\right)\)
\(m_{\text{dung dịch sau phản ứng}}=120+132-23.3=228.7\left(g\right)\)
\(C\%_{H_2SO_4\left(dư\right)}=\dfrac{0.1\cdot98}{228.7}\cdot100\%=4.28\%\)
\(C\%_{HCl}=\dfrac{0.2\cdot36.5}{228.7}\cdot100\%=3.2\%\)
Đúng 3
Bình luận (1)
Cho 60mL dung dịch HCl 0,1M tác dụng vừa đủ với V mL dung dịch Ba( OH)2 0,2M
a/ Viết PTHH
b/ Tính giá trị của V
c/ Tính nồng độ mol của dung dịch sau phản ứng
a, \(2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
b, \(n_{HCl}=0,06.0,1=0,006\left(mol\right)\)
Theo PT: \(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{HCl}=0,003\left(mol\right)\)
\(\Rightarrow V_{Ba\left(OH\right)_2}=\dfrac{0,003}{0,2}=0,015\left(l\right)=15\left(ml\right)\)
c, \(n_{BaCl_2}=\dfrac{1}{2}n_{Ba\left(OH\right)_2}=0,003\left(mol\right)\Rightarrow C_{M_{BaCl_2}}=\dfrac{0,003}{0,06+0,015}=0,04\left(M\right)\)
Đúng 2
Bình luận (0)
\(a/2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\\ b/n_{HCl}=0,06.0,1=0,006mol\\ n_{Ba\left(OH\right)_2}=n_{BaCl_2}=0,006:2=0,003mol\\ V_{Ba\left(OH\right)_2}=\dfrac{0,003}{0,2}=0,015l\\ c/C_{M_{BaCl_2}}=\dfrac{0,003}{0,06+0,015}=0,04M\)
Đúng 1
Bình luận (1)
Cho 300 ml dung dịch HCl 4 M tác dụng hoàn toàn với dung dịch A gồm NaOH 1M và Ba(OH)22M. Tính pH của dung dịch sau khi phản ứng
Cho 100 ml dung dịch H2SO4 2M tác dụng với 100 ml dung dịch Ba(NO3)2 1M. Nồng độ mol của dung dịch sau phản ứng lần lượt là:A. H2SO4 1M và HNO3 0,5M. B. BaSO4 0,5M và HNO3 1M. C. HNO3 0,5M và Ba(NO3)2 0,5M. D. H2SO4 0,5M và HNO3 1M
Đọc tiếp
Cho 100 ml dung dịch H2SO4 2M tác dụng với 100 ml dung dịch Ba(NO3)2 1M. Nồng độ mol của dung dịch sau phản ứng lần lượt là:
A. H2SO4 1M và HNO3 0,5M. B. BaSO4 0,5M và HNO3 1M. C. HNO3 0,5M và Ba(NO3)2 0,5M. D. H2SO4 0,5M và HNO3 1M
100ml = 0,1l
Số mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=2.0,1=0,2\left(mol\right)\)
100ml = 0,1l
Số mol của dung dịch bari nitrat
CMBa(NO3)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,1=0,1\left(mol\right)\)
Pt : H2SO4 + Ba(NO3)2 → 2HNO3 + BaSO4\(|\)
1 1 2 1
0,2 0,1 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\)
⇒ H2SO4 dư , Ba(NO3)2 phản ứng hết
⇒ Tính toán dựa vào số mol của Ba(NO3)2
Số mol của axit nitric
nHNO3 = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Số mol dư của dung dịch axit sunfuric
ndư = nban đầu - nmol
= 0,2 - (0,1. 1)
= 0,1 (mol)
Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng = 0,1 + 0,1
= 0,2 (l)
Nồng độ mol của axit nitric
CMHNO3 = \(\dfrac{n}{V}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Nồng độ mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
⇒ Chọn câu : D
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Có 500 ml dung dịch X chứa
Na
+
,
NH
4
+
,
CO
3
2
-
và
SO
4
2
-
. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy...
Đọc tiếp
Có 500 ml dung dịch X chứa Na + , NH 4 + , CO 3 2 - và SO 4 2 - . Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thu được 43 gam kết tủa. Lấy 200 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu được 8,96 lít khí NH 3 . Các phản ứng hoàn toàn, các thể tích khí đều đo ở đktc. Tính tổng khối lượng muối có trong 300 ml dung dịch X?
A. 23,8 gam.
B. 86,2 gam.
C. 71,4 gam.
D. 119,0 gam.
Có 500 ml dung dịch X chứa Na+, NH4+, CO32– và SO42–. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thu được 43 gam kết tủa. Lấy 200 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu được 8,96 lít khí NH3. Các phản ứng hoàn toàn, các thể tích khí đều đo ở đktc. Tính tổng khối lượng muối có trong 300 ml dung dịch X ? A. 23,8 gam. B. 86,2 gam. C. 71,4 gam. D. 119,0 gam.
Đọc tiếp
Có 500 ml dung dịch X chứa Na+, NH4+, CO32– và SO42–. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thu được 43 gam kết tủa. Lấy 200 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu được 8,96 lít khí NH3. Các phản ứng hoàn toàn, các thể tích khí đều đo ở đktc. Tính tổng khối lượng muối có trong 300 ml dung dịch X ?
A. 23,8 gam.
B. 86,2 gam.
C. 71,4 gam.
D. 119,0 gam.
Chọn đáp án C
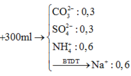
Xét trong 100 ml dung dịch X: 2H⁺ + CO32– → CO2 + H2O ⇒ nCO32– = nkhí = 0,1 mol.
Ba2+ + CO32– → BaCO3 || Ba2+ + SO42– → BaSO4 ⇒ nSO42– = (43 - 0,1 × 197) ÷ 233 = 0,1 mol.
NH4+ + OH– → NH3 + H2O ⇒ nNH4+ = nNH3 = 0,4 ÷ 2 = 0,2 mol.Bảo toàn điện tích: nNa+ = 0,2 mol.
⇒ mmuối trong 300ml X = 3 × (0,2 × 23 + 0,2 × 18 + 0,1 × 60 + 0,1 × 96) = 71,4(g) ⇒ chọn C.
Đúng 0
Bình luận (0)
Có 500 ml dung dịch X chứa
Na
+
,
NH
4
+
,
CO
3
2
-
và
...
Đọc tiếp
Có 500 ml dung dịch X chứa Na + , NH 4 + , CO 3 2 - và SO 4 2 - . Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl 2 thu được 43 gam kết tủa. Lấy 200 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu được 8,96 lít khí NH 3 . Các phản ứng hoàn toàn, các thể tích khí đều đo ở đktc. Tính tổng khối lượng muối có trong 300 ml dung dịch X ?
A. 23,8 gam.
B. 86,2 gam.
C. 71,4 gam.
D. 119,0 gam.
Trộn 100ml dung dịch HCL 1M với 100 ml dung dịch H2So4 0,5m thu được dung dịch D.
a. Tính nồng độ các ion trong dung dịch D.
b. Cho dung dịch D tác dụng vừa đủ với V ml dung dịch Ba(oh)2. Tính V.
\(n_{HCl}=Cm.V=1.0,1=1mol\)
\(n_{H_2SO_4}=Cm.V=0,5.0,1=0,05mol\)
Thể thích của dd D là 200ml = 0,2l
\([H^+]=\frac{n_{HCl}+2.n_{H_2SO_4}}{V}=\frac{0,1+0,1}{0,2}=1M\)
\([Cl^-]=\frac{n_{HCl}}{V}=\frac{0,1}{0,2}=0,5M\)
\([SO_4^{2-}]=\frac{n_{H_2SO_4}}{V}=\frac{0,05}{0,2}=0,25M\)
Khi cho dd D vào \(Ba\left(OH\right)_2\) chỉ có \(H_2SO_4\) tác dụng, tạo kết tủa
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
\(0,05....\rightarrow0,05mol\)
\(\rightarrow m_{BaSO_4}=n.M=0,05.233=11,65g\)