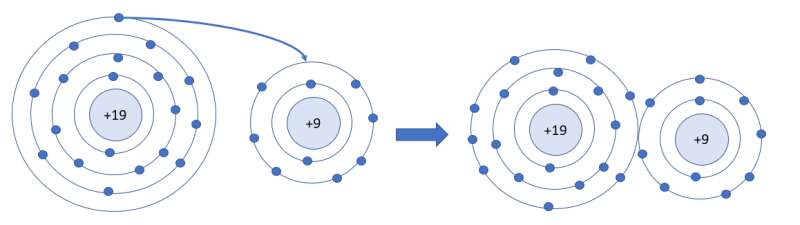
Trong phân tử HCl, lớp electron ngoài cùng của Cl và H lần lượt có bao nhiêu electron?

Những câu hỏi liên quan
Nguyên tử nitrogen và silicon có số electron lần lượt là 7 e và 14 e. Hãy cho biết nguyên tử nitrogen và silicon có bao nhiêu lớp electron và có bao nhiêu electron ở lớp ngoài cùng
Nguyên tử Nitrogen: Có `2` lớp electron và có `5` electron lớp ngoài cùng.
Nguyên tử Silicon: Có `3` lớp electron và có `4` electron lớp ngoài cùng.
Đúng 1
Bình luận (0)
Nguyên tử X và Y có cấu hình electron ngoài cùng lần lượt là 3sx và 3py. Biết phân lớp 3s của hai nguyên tử hơn kém nhau 1 electron. Hợp chất của X và Y có dạng X2Y. Cấu hình electron lớp ngoài cùng của X và Y lần lượt là A. 3s1 và 3s23p2. B. 3s2 và 3s23p1 C. 3s2 và 3s23p2 D. 3s1 và 3s23p4
Đọc tiếp
Nguyên tử X và Y có cấu hình electron ngoài cùng lần lượt là 3sx và 3py. Biết phân lớp 3s của hai nguyên tử hơn kém nhau 1 electron. Hợp chất của X và Y có dạng X2Y. Cấu hình electron lớp ngoài cùng của X và Y lần lượt là
A. 3s1 và 3s23p2.
B. 3s2 và 3s23p1
C. 3s2 và 3s23p2
D. 3s1 và 3s23p4
Nguyên tử X và Y có cấu hình electron ngoài cùng lần lượt là 3sx và 3py. Biết phân lớp 3s của hai nguyên tử hơn kém nhau 1 electron. Hợp chất của X và Y có dạng X2Y. Cấu hình electron lớp ngoài cùng của X và Y lần lượt là : A. 3s1 và 3s23p2. B. 3s2 và 3s23p1. C. 3s2 và 3s23p2. D. 3s1 và 3s23p4.
Đọc tiếp
Nguyên tử X và Y có cấu hình electron ngoài cùng lần lượt là 3sx và 3py. Biết phân lớp 3s của hai nguyên tử hơn kém nhau 1 electron. Hợp chất của X và Y có dạng X2Y. Cấu hình electron lớp ngoài cùng của X và Y lần lượt là :
A. 3s1 và 3s23p2.
B. 3s2 và 3s23p1.
C. 3s2 và 3s23p2.
D. 3s1 và 3s23p4.
Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K hết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron. Vẽ sơ đồ tạo thành liên kết trong phân tử potassium fluoride
Cấu hình electron lớp ngoài cùng của nguyên tử Cl (Z17), Ca (Z20) và liên kết giữa canxi và clo trong hợp chất
C
a
C
l
2
lần lượt là A.
3
s
2
3
p
5
,
4
s
1
và liên kết cộng hóa trị B.
3
s
2...
Đọc tiếp
Cấu hình electron lớp ngoài cùng của nguyên tử Cl (Z=17), Ca (Z=20) và liên kết giữa canxi và clo trong hợp chất C a C l 2 lần lượt là
A. 3 s 2 3 p 5 , 4 s 1 và liên kết cộng hóa trị
B. 3 s 2 3 p 3 , 4 s 2 và liên kết ion
C. 3 s 2 3 p 5 , 4 s 2 và liên kết ion
D. 3 s 2 3 p 3 , 4 s 1 và liên kết cộng hóa trị
Chọn C
Cấu hình electron nguyên tử Cl là [Ne]3s23p5 → Loại B và D
Cấu hình electron nguyên tử Ca là [Ar]4s2 → loại A
Liên kết hình thành giữa Ca (kim loại mạnh) và Cl (phi kim mạnh) trong hợp chất CaCl2 là liên kết ion.
Đúng 0
Bình luận (0)
Phân lớp electron ngoài cùng của hai nguyên tử A và B lần lượt là 3p và 4s. Tổng số electron của 2 phân lớp bằng 5 và hiệu số electron của chúng bằng 3. Tổng số hạt mang điện trong 2 nguyên tử A và B là *
Gọi phân lớp ngoài cùng của 2 nguyên tử A, B lần lượt là 3pa và 4sb
Vì phân lớp 4s chỉ có tối đa 2 electron nên hiệu số của 2 phân lớp là hiệu số giữa phân lớp 3p của nguyên tử A với phân lớp 4s của nguyên tử B. (a<b)
Ta có hpt: \(\left\{{}\begin{matrix}a+b=5\\a-b=3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=4\\b=1\end{matrix}\right.\)
=> Nguyên tử A có cấu hình: 1s22s22p63s23p4 => Z(A)= 16
=> P(A)=E(A)=Z(A)=16
=> Nguyên tử A có số hạt mang điện là: 16+16=32(hạt)
Nguyên tử B có cấu hình: 1s22s22p63s23p64s1 =>Z(B)=19
=> P(B)=E(B)=Z(B)=19
=> Nguyên tử B có số hạt mang điện là: 19+19=38(hạt)
Chúc em học tốt!
Đúng 2
Bình luận (0)
A : $1s^22s^22p^63s^23p^4$
B : $1s^2 2s^2 2p^6 3s^2 3p^6 4s^1$
Số hạt mang điện trong A : 16.2 = 32
Số hạt mang điện trong B : 19.2 = 38
Đúng 0
Bình luận (0)
Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine
a) Mỗi nguyên tử Cl cần thêm bao nhiêu electron vào lớp ngoài cùng để có lớp vỏ tương tự khí hiếm
b) Hãy vẽ sơ đồ tạo thành liên kết trong phân tử chlorine
Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Từ đây em tự vẽ khi mỗi nguyên tử góp 1e dùng chung
Đúng 1
Bình luận (0)
Nguyên tử R mất đi 1 electron tạo ra cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Cấu hình electron và số hiệu nguyên tử của R lần lượt là A. 1s22s22p5 và 9 B. 1s22s22p63s1 và 10 C. 1s22s22p6 và 10 D. 1s22s22p63s1 và 11
Đọc tiếp
Nguyên tử R mất đi 1 electron tạo ra cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Cấu hình electron và số hiệu nguyên tử của R lần lượt là
A. 1s22s22p5 và 9
B. 1s22s22p63s1 và 10
C. 1s22s22p6 và 10
D. 1s22s22p63s1 và 11
+ có cấu hình e: 1s22s22p6
Mà R → R+ + 1e
Vậy R có cấu hình: 1s22s22p63s1; R có số hiệu nguyên tử = số electron = 11 → Chọn D.
Đúng 0
Bình luận (0)
Nguyên tử R mất đi 1 electron tạo ra cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Cấu hình electron và số hiệu nguyên tử của R lần lượt là A. 1s22s22p5 và 9. B. 1s22s22p63s1 và 10. C. 1s22s22p6 và 10. D. 1s22s22p63s1 và 11.
Đọc tiếp
Nguyên tử R mất đi 1 electron tạo ra cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Cấu hình electron và số hiệu nguyên tử của R lần lượt là
A. 1s22s22p5 và 9.
B. 1s22s22p63s1 và 10.
C. 1s22s22p6 và 10.
D. 1s22s22p63s1 và 11.
Đáp án D
R+ có cấu hình e: 1s22s22p6
Mà R → R+ + 1e
Vậy R có cấu hình: 1s22s22p63s1; R có số hiệu nguyên tử = số electron = 11
→ Chọn D.
Đúng 0
Bình luận (0)